87
Estructura atómica y molecular
1.
El átomo divisible
John Dalton
(1766-1844) afirmó que la materia es discontinua y está formada por
partículas indivisibles, denominadas
átomos.
Sin embargo, esta idea de indivisibili-
dad empezó a cuestionarse a mediados del siglo
xix
, cuando se inició el estudio del
comportamiento de la materia frente a la electricidad.
¿Es el átomo la partícula más
pequeña de la materia, tal y como creía Dalton?
1.1.
Descubrimiento del electrón
En 1897, el inglés
Joseph John Thomson
(1856-1940), estudiando el grado de
desviación de los recién descubiertos
rayos catódicos
(flujo de partículas que salen
del cátodo de los tubos de descarga rellenos de gas enrarecido), en presencia de
campos eléctricos y magnéticos, demostró que esos «rayos» eran, en realidad, par-
tículas cargadas negativamente a las que llamó
electrones
, denominación sugerida
por el físico irlandés
George Stoney
(1826-1911).
Thomson midió la relación entre la carga y la masa del electrón, 1,759
⋅
10
11
C/kg,
y al comprobar que era tan elevada, dedujo que la masa del electrón debía de ser
muy pequeña.
Fue el estadounidense
Robert Millikan
(1868-1953), con su experimento de la «gota
de aceite», quien, en 1909, determinó la
carga del electrón: 1,602
⋅
10
−
19
C
. Una vez
conocida, se pudo hallar la
masa del electrón: 9,107
⋅
10
−
31
kg
.
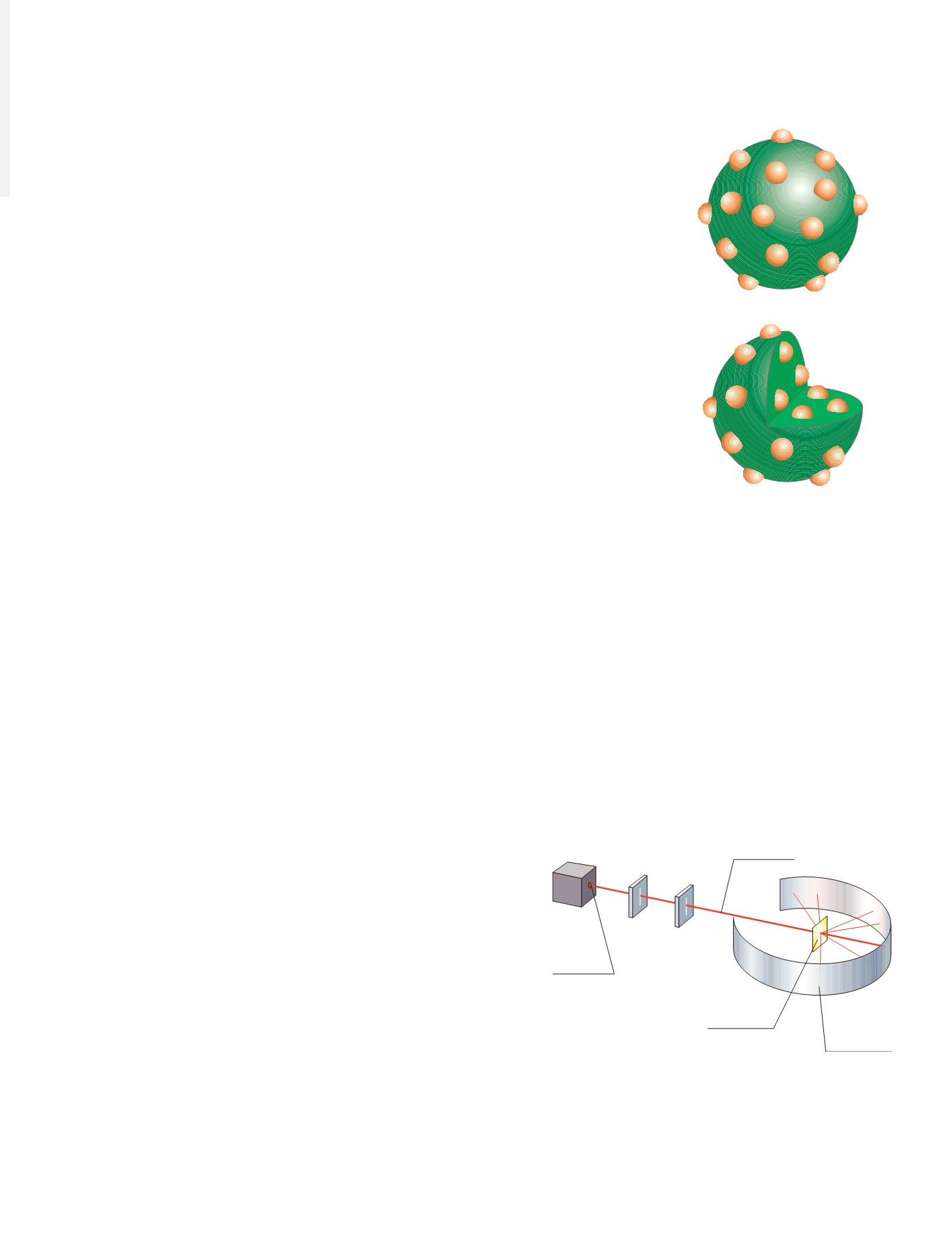
Modelo atómico de Thomson
¿Cómo encajan los electrones dentro de un átomo eléctricamente neutro y
supuestamente macizo?
En 1904, Thomson sugirió que, al ser la masa de los electrones tan pequeña es de
suponer que casi toda la masa del átomo se almacena en la carga positiva, una masa
fluida que ocupa todo el volumen atómico; entonces, los electrones, al poseer carga
negativa, pueden estar incrustados (en posiciones equidistantes y lo más alejados
unos de otros) en esa masa fluida y positiva (figura 4.1).
1.2.
Descubrimiento del protón
En 1886, el alemán
Eugen Goldstein
(1850-1930) observó, en un tubo de rayos cató-
dicos con cátodo perforado, unos nuevos rayos que atravesaban dichos orificios o
ca-
nales.
Los llamó
rayos canales o positivos,
porque viajaban hacia el electrodo nega-
tivo, y sugirió que podían ser partículas procedentes del átomo. Sin embargo, al hallar
la relación carga/masa encontró que esta variaba dependiendo del gas
que hubiera en el tubo. Solo cuando el gas era dihidrógeno la relación
carga/masa era la mayor de todas las observadas (9,573
⋅
10
7
C/kg), lo
que parecía indicar que, por lo menos en el átomo de hidrógeno, existía
ese tipo de partículas. Todos estos trabajos fueron olvidados.
Modelo atómico de Rutherford
En 1910, un grupo de investigadores dirigido por
Ernest Rutherford
(1871-1937) realizó un experimento, ya clásico (figura 4.2), que mos-
traba que existen en el átomo dos regiones claramente diferenciadas:
❚❚
El
núcleo,
que ocupa una fracción muy pequeña del volumen total
del átomo (
∼
10
−
12
), acapara la mayor parte de sumasa y está cargado
positivamente.
❚❚
La
corteza,
extensa región donde los electrones giran alrededor del
núcleo. Como la masa de los electrones es tan pequeña, se puede
decir que es una zona de vacío. Por tanto, el átomo no es una esfera
maciza.
Figura 4.1.
El modelo del «pudin de pasas»
de Thomson explicaba el fenómeno de la
electrización: ciertas acciones exteriores,
como el frotamiento, pueden desplazar a
los electrones de sus posiciones e, incluso,
arrancarlos, lo que dotaría al átomo, en este
último caso, de un exceso de carga positiva;
si la acción exterior introduce en el átomo
nuevos electrones, este adquiere un exceso
de carga negativa.
−
−
−
−
−
−
−
−
−
−
−
−
−
−
−
−
−
−
−
−
−
−
−
−
−
−
−
−
−
−
Figura 4.2.
La mayoría de las partículas
α
(un tipo de iones
positivos procedentes de una fuente radiactiva) impactan sobre
una fina lámina de oro, atraviesan dicha lámina y producen
destellos luminosos en la parte de la pantalla recubierta con ZnS.
Unas pocas se desvían un ángulo pequeño, y las menos
(1 de cada 20000) experimentan grandes desviaciones e, incluso,
rebotan.
Pantalla
fluorescente
Fuente
radiactiva
Protección
de Pb
Rendijas
Haz de
partículas
α
Placa de oro


