93
Estructura atómica y molecular
3.2.
Espectros atómicos
Espectros de emisión
En 1859,
Robert Wilhelm Bunsen
(1811-1899) y
Gustav R. Kirchhoff
(1824-1887)
desarrollaron un aparato denominado
espectroscopio
con el que descubrieron
que, si calentamos una sustancia hasta la incandescencia y hacemos pasar su luz a
través de un prisma óptico, esta se descompone en un conjunto de radiaciones que,
sobre una lámina de vidrio, aparecen como un grupo de rayas o líneas coloreadas
separadas por espacios oscuros. Al conjunto de rayas se le llama
espectro de emi-
sión
de la sustancia. El número y la posición de las líneas es una característica de
cada sustancia que emite la luz, algo así como su «código de barras» (figura 4.9).
Los investigadores se dieron cuenta enseguida de que cada elemento químico gene
ra su propio espectro de emisión característico por el que puede ser reconocido, he-
cho que convierte a la
espectroscopia de emisión atómica
(EEA) en un excelente
método de
análisis cualitativo
para gases monoatómicos (figura 4.10); y también
cuantitativo,
ya que la intensidad de una línea concreta nos da una idea de lo con-
centrada que está la muestra en ese elemento. Hay que tener en cuenta que, debido
a las relativamente bajas temperaturas que alcanzan las llamas (siempre que sea esta
la técnica usada para atomizar y excitar los componentes de la muestra), el uso de
este método está limitado a los elementos más fáciles de excitar, como los metales
alcalinos y alcalinotérreos, que poseen energías de ionización muy bajas.
Espectros de absorción
Acabamos de ver que para que un átomo emita radiación hay que calentarlo o so-
meterlo a descargas eléctricas, pero
¿podrá absorber radiación?
En 1802,
W. H. Wollaston
(1776-1828) encontró en el espectro de la luz solar unas
líneas oscuras cuya existencia malinterpretó. En 1814,
Joseph Fraunhofer
(1787-
1826) redescubrió esas líneas y las estudió cuidadosamente, aunque tampoco supo
explicar su presencia.
No fue hasta el descubrimiento del espectroscopio, cuando Kirchhoff demostró que
las
líneas brillantes de los espectros de emisión se convertían en oscuras
cuan-
do el gas se iluminaba desde atrás con luz blanca. Kirchhoff llegó a la conclusión
de que eran los vapores «fríos» de las capas externas del sol, y también algunas
moléculas de la atmósfera terrestre, los que mediante
absorción de frecuencias
dejaban esas líneas oscuras en el
espectro del sol.
Espectro de absorción:
conjunto de rayas negras que deja una sustancia sobre
una banda coloreada después de absorber la radiación proporcionada por una
fuente luminosa externa.
Si comparamos el espectro de emisión de un elemento con su correspondiente espec-
tro de absorción, se observa que, allí donde en el de emisión aparece una línea brillan-
te, en el de absorción, a la misma frecuencia, surge una línea oscura. Es como si ambos
espectros fueran el positivo y el negativo de una misma fotografía (figura 4.11).
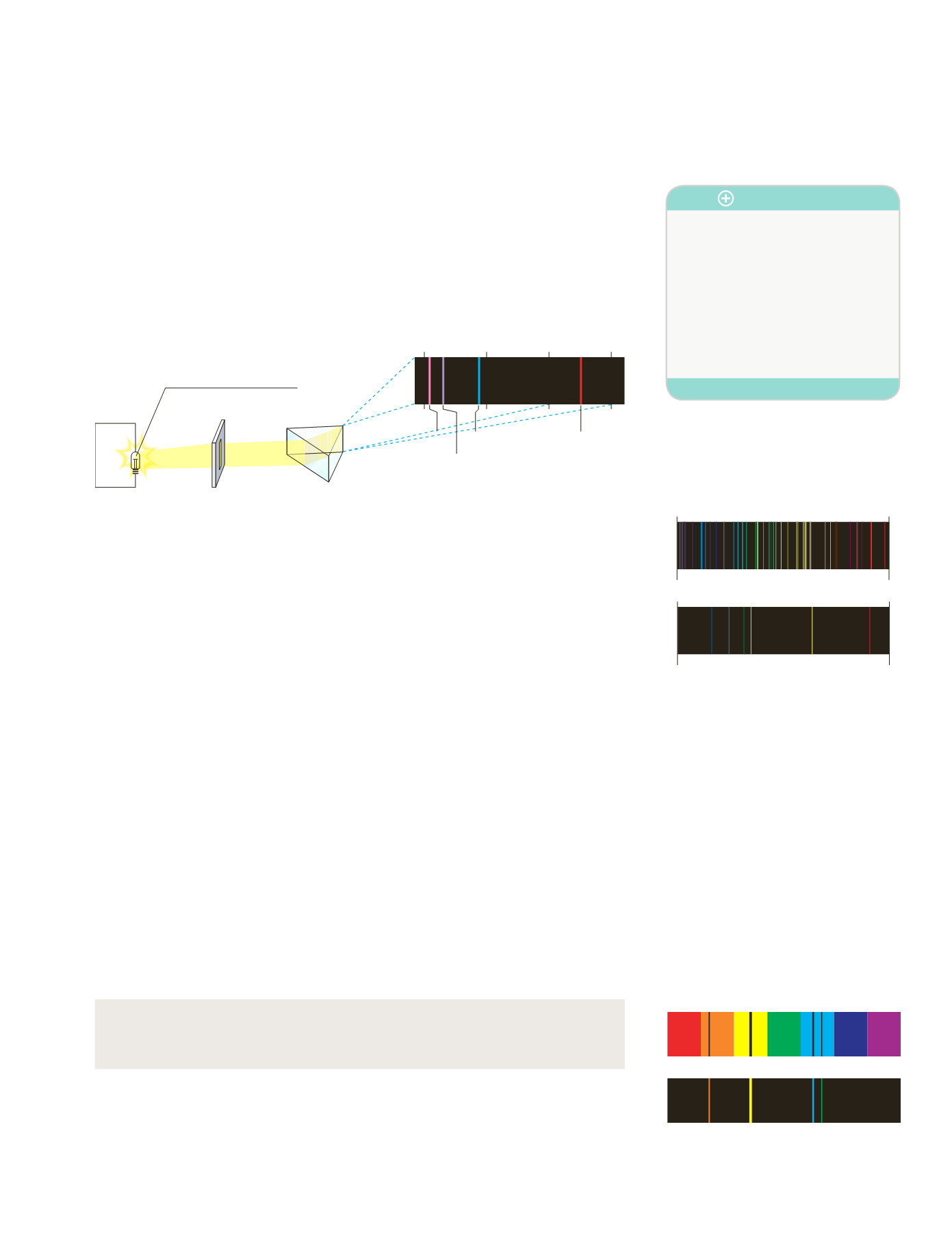
Figura 4.9.
Elementos básicos de un espectroscopio.
Alto
voltaje
Lámpara de hidrógeno
λ
(nm) 400
500
600
700
656,2
486,1
410,1
434,0
Espectroscopio
Es el instrumento que se utiliza para
observar los espectros atómicos. Consta
de cuatro elementos: una
fuente de
radiación
(una llama o un tubo de des-
carga), un
prisma óptico
(para descom-
poner las radiaciones), un
anteojo
y un
registrador
(que permiten observar e
identificar las radiaciones simples).
Figura 4.10.
Espectros de emisión del
mercurio y del helio.
400 nm
700 nm
400 nm
700 nm
Figura 4.11.
Espectros de emisión y
absorción de un mismo elemento.
Emisión
Absorción


