97
Estructura atómica y molecular
4.4.
Correcciones al modelo atómico de Bohr
Cuando se construyeron espectroscopios de mayor poder resolutivo, pudo compro-
barse que las rayas poseían una estructura fina. Algunas eran, en realidad, dos rayas
muy próximas. Para explicar este hecho en 1915
Arnold Sommerfeld
(1868-1951)
sugirió que a excepción del primer nivel, que solo tiene una órbita circular, el resto
de niveles
tienen tantas órbitas como indica su número
(dos el segundo, tres el
tercero, etc.), de las cuales
una es circular y el resto elípticas.
En cada órbita elíp-
tica el electrón se movería con una energía ligeramente distinta a la correspondiente
circular. Esta nueva restricción le llevó a introducir
un segundo número cuántico,
l.
En 1896, el holandés
Pieter Zeeman
(1865-1943) descubrió que las rayas espectra-
les sufrían un nuevo desdoblamiento cuando el espectro se realizaba bajo la influen-
cia de un intenso campo magnético, lo que se interpretó afirmando que las órbitas
elípticas podían adoptar
distinta orientación espacial.
Esta nueva restricción le
llevó a introducir
un tercer número cuántico,
m.
Finalmente, en 1925, los también holandeses
George Uhlenbeck
(1900-1988), y
Samuel Goudsmit
(1902-1978) comprobaron experimentalmente, empleando po-
tentes campos magnéticos y métodos espectroscópicos de alto poder de resolución,
el desdoblamiento de cada una de las rayas de Zeeman. Con esto se confirmaba la
hipótesis lanzada tres años antes por Stern y Gerlach de que
el electrón, al girar
sobre su eje, creaba un pequeño campo magnético en la dirección del giro.
Esta nueva restricción obligó a introducir
un cuarto número cuántico,
s.
4.5.
De las orbitas a los orbitales
En 1925, el francés
Louis-Victor de
Broglie
(1892-1987) sostuvo que la
materia y la radiación deberían poseer
propiedades tanto de partículas como
de ondas.
En 1927, el
principio de incertidum-
bre
enunciado por
Werner Heisen-
berg
(1901-1976) establecía que:
Es imposible conocer simultánea-
mente y con precisión la posición
y la velocidad de un electrón en el
átomo. Cuanto mejor se conozca la
posición, con más error se conocerá
la velocidad que lleva.
Entre 1925 y 1930,
Werner Heisenberg, Erwin Schrödinger
(1887-1961) y
Paul
Dirac
(1902-1984), entre otros, desarrollaron una nueva mecánica que tenía en
cuenta la naturaleza ondulatoria del electrón: la
mecánica cuántica.
El enfoque que debía adoptar esta mecánica tenía que ser diferente al de la
mecánica clásica; había que abandonar cualquier modelo mecánico del áto-
mo del tipo del de Bohr y centrarse en el planteamiento y la resolución de las
ecuaciones matemáticas que caracterizan a las ondas estacionarias. Por otra
parte, al no poder localizar con exactitud el electrón, debemos hablar de la
probabilidad
de encontrarlo en una cierta región del espacio alrededor del
núcleo atómico, donde la energía sea menor.
Un
orbital atómico
es la zona del espacio en la que hay mayor probabilidad
(> 90%) de encontrar un electrón con determinada energía.
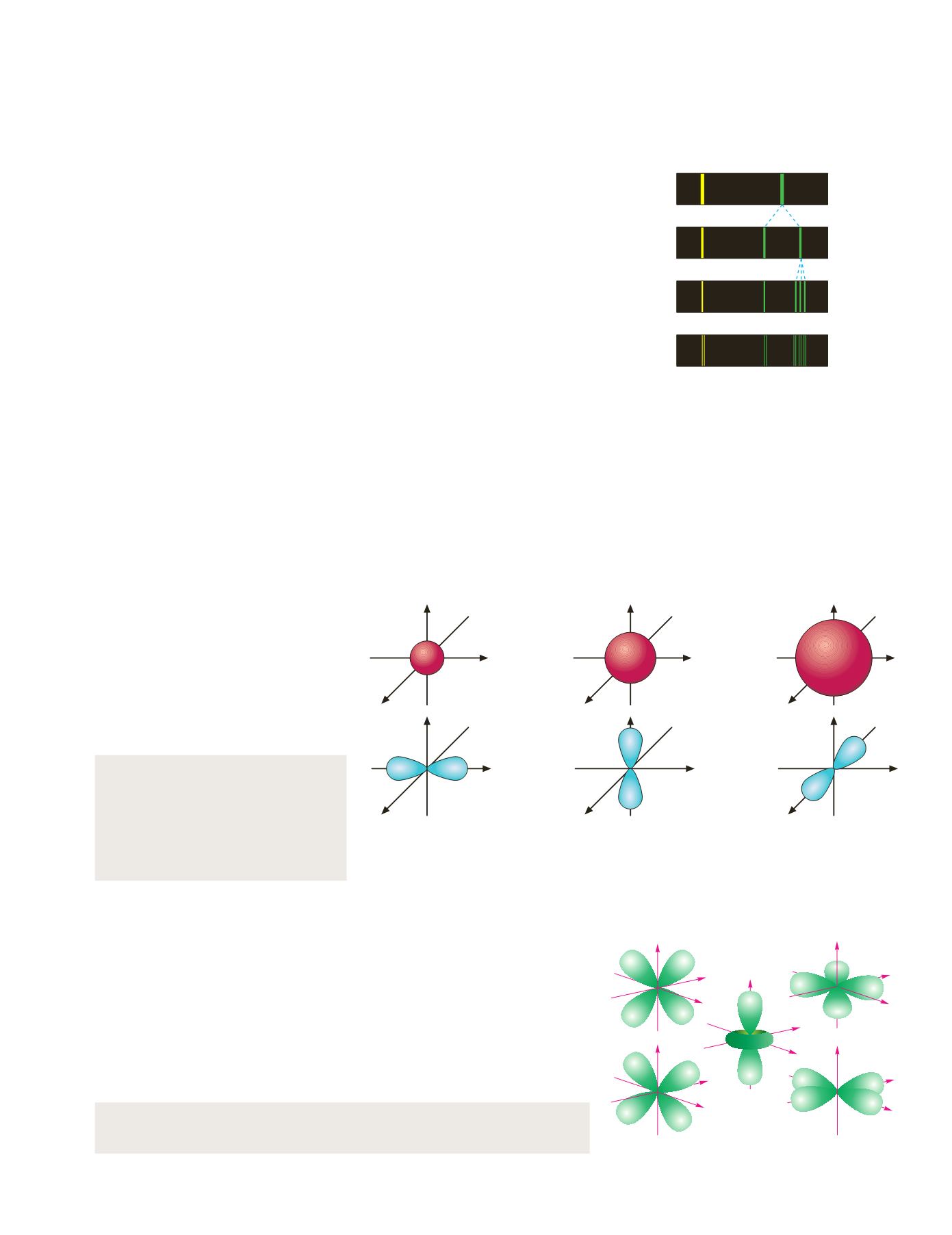
Figura 4.17.
Evolución de los espectros.
Bohr
nivel1
nivel2
Sommerfeld
Zeeman
Uhlenbeck-
Goudsmit
Figura 4.18.
Las soluciones de la ecuación de Schrödinger originan los cuatro números cuánticos:
n, l, m, s.
Los tres primeros determinan el tipo de orbital en el que se encuentra un determinado
electrón en el átomo. La forma de los orbitales s es esférica. Los tres orbitales p se diferencian en la
orientación espacial.
orbital 1s
orbital p
y
Z
Y
X
orbital 2s
orbital p
z
Z
Y
X
orbital 3s
orbital p
x
Z
Y
X
Figura 4.19.
Representación de los orbitales
d
.
y
x
z
y
x
z
y
x
z
y
x
z
z
y
x
d
yz
d
xy
d
xz
d
x
2
d
x
2
−
y
2
=


