124
6
Comprovació de la llei de conservació de la massa
TÈCNIQUES DE TREBALL I EXPERIMENTACIÓ
❚❚
Una balança digital.
❚❚
Un matràs d'Erlenmeyer.
❚❚
Un tub d'assaig menut.
❚❚
Un globus.
❚❚
Carbonat de calci mòlt.
❚❚
Àcid clorhídric 1 M.
Materials
1.
Pesa en una balança aproximadament 0,4 g de CaCO
3
al matràs d'Erlenmeyer.
2.
Aboca 50 mL de HCl al tub d'assaig i introdueix aquest tub, amb molta cura,
a l'interior del matràs d'Erlenmeyer.
3.
Col·loca el globus a la boca del matràs i pesa el conjunt a la balança. Anota
aquest valor.
4.
Mou el matràs d'Erlenmeyer de manera que el HCl que conté el tub d'assaig
tombe damunt del CaCO
3
i ambdós comencen a reaccionar.
5.
La reacció acaba quan ja no hi observes més despreniment de gasos.
6.
Torna a pesar el conjunt a la balança i anota el resultat.
Procediment
Per a analitzar els resultats utilitza una taula com aquesta:
Anàlisi dels resultats
Massa inicial del conjunt
Massa final del conjunt
…
…
…
…
Quan el carbonat de calci, CaCO
3
, reacciona amb l'àcid clorhí-
dric, HCl, es forma una substància sòlida, clorur de calci, CaCl
2
,
i es desprén una substància gasosa, diòxid de carboni, CO
2
.
L'equació química ajustada d'aquesta reacció és:
CaCO
3
(s)
+
2 HCl (aq)
→
CaCl
2
(s)
+
H
2
O
+
CO
2
(g)
Per a comprovar si la massa es conserva en aquesta reacció química no la po-
dem dur a terme en un recipient obert, perquè el CO
2
escaparia a l'atmosfera
i no en podríem mesurar la massa. Tampoc no la podem fer en un recipient
tancat hermèticament, perquè el gas que es desprén pujaria la pressió a
l'interior del recipient fins a fer-lo esclatar. Per tant, és convenient utilitzar
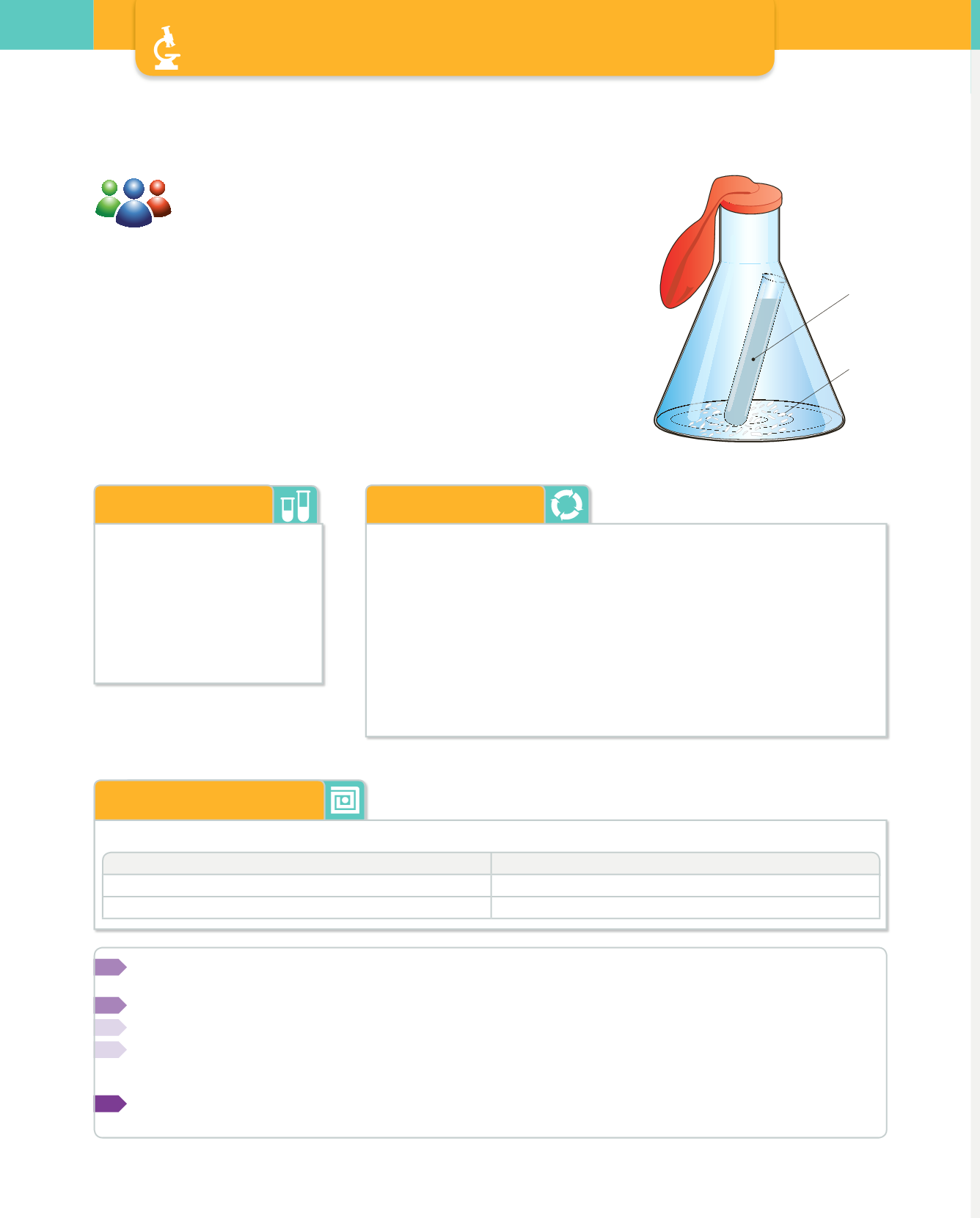
un recipient tancat el volum del qual puga augmentar fàcilment quan es
desprenga el CO
2
. Una solució molt senzilla consisteix a acoblar un globus a
la boca d'un matràs d'Erlenmeyer.
CaCO
3
HCl
Roman constant la massa del conjunt? Si no és així, quins errors experimentals han pogut intervenir en la realització de
la pràctica? Repeteix l'experiència i evita els errors experimentals observats.
Com a resultat d'aquesta experiència, enuncia amb les teues paraules la llei de conservació de la massa.
Per què s'unfla el globus col·locat a la boca del matràs d'Erlenmeyer?
Lavoisier va cremar fòsfor i va recollir el gas que es produïa; així va comprovar que aquest gas sempre pesava més que el
fòsfor abans de la combustió i va deduir que algun gas contingut en l'aire havia reaccionat amb el fòsfor. Com s'anomena
el gas contingut en l'aire que ha participat en la combustió del fòsfor?
Si posem 5 g de CaCO
3
en un got de vidre i hi afegim 3,65 g de HCl, obtenim 5,55 g d'una substància sòlida. Per què
sembla que no es compleix la llei de Lavoisier?
1
2
3
4
5


