79
3
El átomo
EJERCICIOS, ACTIVIDADES Y TAREAS
37
Corrige las afirmaciones que sean falsas.
a)
El nivel energético 2 puede contener como máximo
18 electrones.
El nivel energético 2 puede contener como máximo 8
electrones.
b)
El nivel energético 1 puede contener como máximo
2 electrones.
Correcta.
c)
El modelo atómico de Rutherford no es válido, por-
que cualquier carga eléctrica que gire debe emitir
radiación y esto no sucede.
Correcta.
d)
El primer postulado de Bohr afirma que el electrón
se mueve alrededor del núcleo en órbitas circulares,
sin que exista emisión de energía.
Correcta.
e)
Según Bohr, todos los electrones de un átomo se en-
cuentran en un mismo nivel de energía.
El electrón, dependiendo de la órbita en la que se encuen-
tra, tiene una determinada energía, que es tanto mayor
cuanto más alejada esté la órbita del núcleo.
38
Responde a las siguientes cuestiones relacionadas con
los modelos atómicos de Bohr, Thomson y Rutherford.
a)
Ordena cronológicamente estos modelos atómicos.
b)
Describe brevemente las características de cada uno
de los modelos.
c)
Asocia cada modelo con uno de los siguientes dibu-
jos:
1.
2.
3.
+
+
+
+
J.J. Thomson (1904)
(modelo pastel de pasas)
E. Rutherford (1909)
(modelo nuclear)
N. Bohr (1013)
(modelo niveles de energía)
a)
Thomson, Rutherford y Bohr.
b)
R
ESPUESTA
LIBRE
.
c)
Dibujo 1: modelo de Thomson; dibujo 2: modelo de Ru-
therford; dibujo 3: modelo de Bohr.
39
Asocia cada término con su definición: número atómi-
co, isótopo, núcleo atómico, ion y neutrón.
a)
El centro de un átomo.
núcleo atómico.
b)
Número de protones en un núcleo.
número ató-
mico.
c)
Partícula nuclear sin carga eléctrica.
neutrón.
d)
Átomo con carga eléctrica.
ion.
e)
Átomos de un mismo elemento con diferente núme-
ro de neutrones en su núcleo.
isótopos.
Cómo dibujar átomos
40
Relaciona los siguientes átomos: helio (2 electrones),
flúor (9 electrones), litio (3 electrones), sodio (11 elec-
trones) y argón (18 electrones) con la configuración
electrónica correspondiente:
a)
2 8 8:
argón.
b)
2:
helio.
c)
2 7:
flúor.
d)
2 1:
litio.
e)
2 8 1:
sodio.
41
Dibuja el núcleo y los niveles de energía de un átomo
de fósforo,
Z
=
15,
A
=
31.
En el núcleo dibujaríamos
+
15p y 16n. En la primera circun-
ferencia 2 electrones, en la segunda 8 y en la tercera 5.
Configuración electrónica: 2 8 5
42
Copia y completa en tu cuaderno el siguiente cuadro:
Átomo
Z A
N.° de
protones
N.° de
electrones
N.° de
neutrones
Distribución
electrónica
Na 11 23 11
11
12
2 8 1
Si
14 28 14
14
14
2 8 4
Ca 20 40 20
20
20
2 8 8 2
43
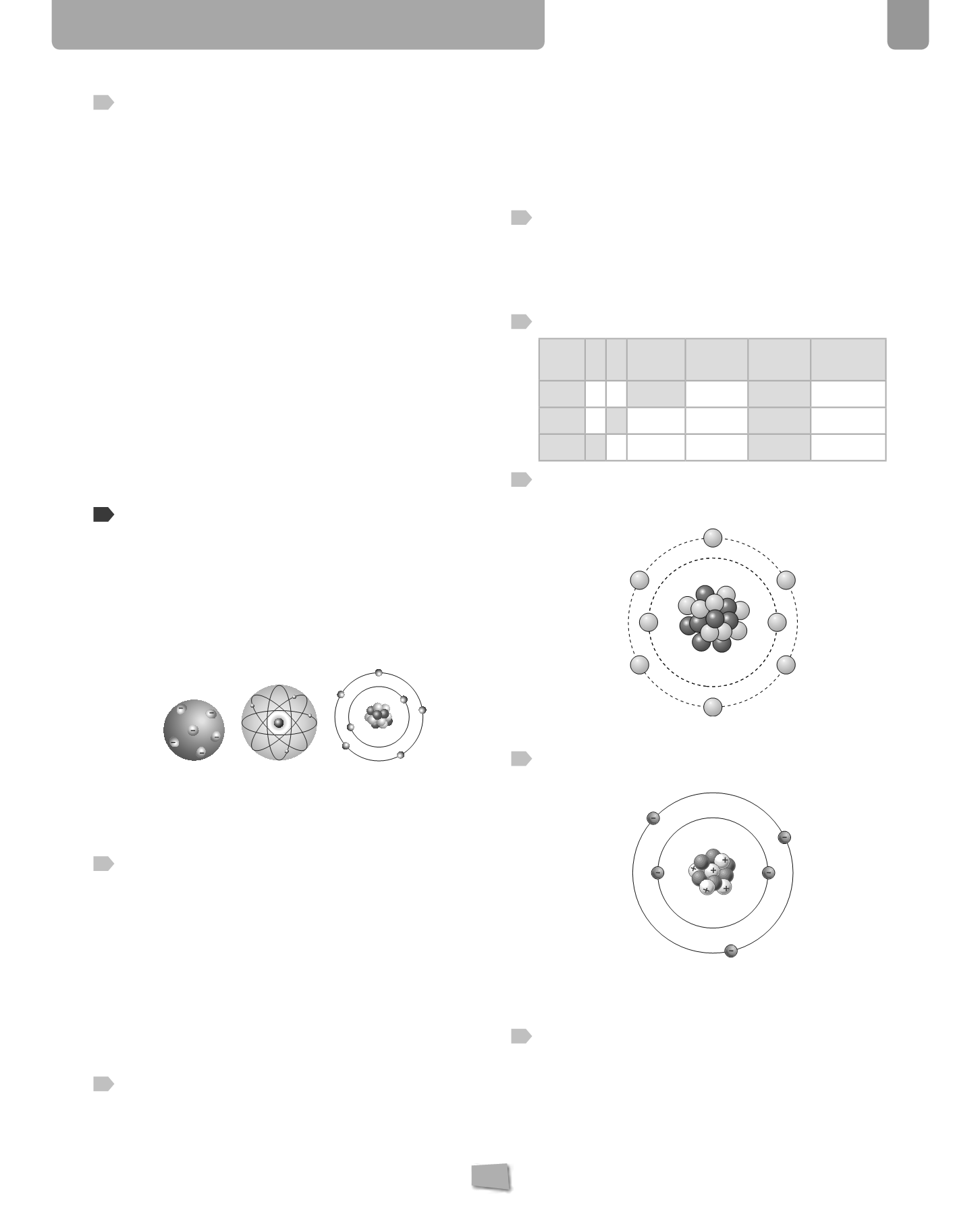
Dibuja un átomo de oxígeno, que tiene 8 protones,
8 neutrones y 8 electrones, y escribe su configuración
electrónica.
--
--
--
--
--
--
--
--
+
+
+
+++
++
Configuración electrónica: 2 6
44
Dibuja en tu cuaderno un átomo de
11
5
B con su configu-
ración electrónica.
Configuración electrónica: 2 3
La radiactividad
45
Responde verdadero o falso y justifica tu respuesta:
a)
La radiactividad es un fenómeno causado por la dis-
tribución de los electrones alrededor del núcleo.
Falso. La radiactividad es un fenómeno nuclear por el
cual los núcleos emiten partículas y radiaciones de for-
ma espontánea.


