68
3
Idees clares
❚❚
Per a Thomson, l’àtom és una
esfera contínua de càrrega
positiva que té quasi tota la
massa i en la qual hi ha in-
crustats els electrons.
❚❚
Mitjançant el model de
Thomson es pot explicar
l’electrització de la matèria.
❚❚
Per a Rutherford, l’àtom té
un nucli central en el qual
està concentrada quasi tota
la seua massa, aportada pels
protons i els neutrons.
❚❚
Els electrons giren a gran ve-
locitat al voltant del nucli.
❚❚
En un àtom elèctricament
neutre, el nombre de protons
coincideix amb el nombre
d’electrons.
❚❚
Els
ions
són àtoms que han
perdut (catió) o guanyat (anió)
algun electró.
3.2.2.
El descobriment dels neutrons
El model descrit anteriorment tenia un inconvenient: la suma de la massa dels protons
més la dels electrons era inferior a la massa de l’àtom en el seu conjunt. Rutherford i
altres investigadors van proposar que en el nucli hi devia haver una altra partícula amb
massa, però sense càrrega elèctrica.
El 1932,
J. Chadwick
(1891-1974) va bombardejar una làmina de beril·li amb partí-
cules positives i va observar que emetia una radiació de gran energia. Posteriorment,
va demostrar que aquesta radiació estava formada per unes partícules elèctricament
neutres, que va denominar
neutrons,
la massa de les quals era una mica més gran
que la del protó.
Massa del neutró
=
1,6749
⋅
10
−
27
kg
3.2.3.
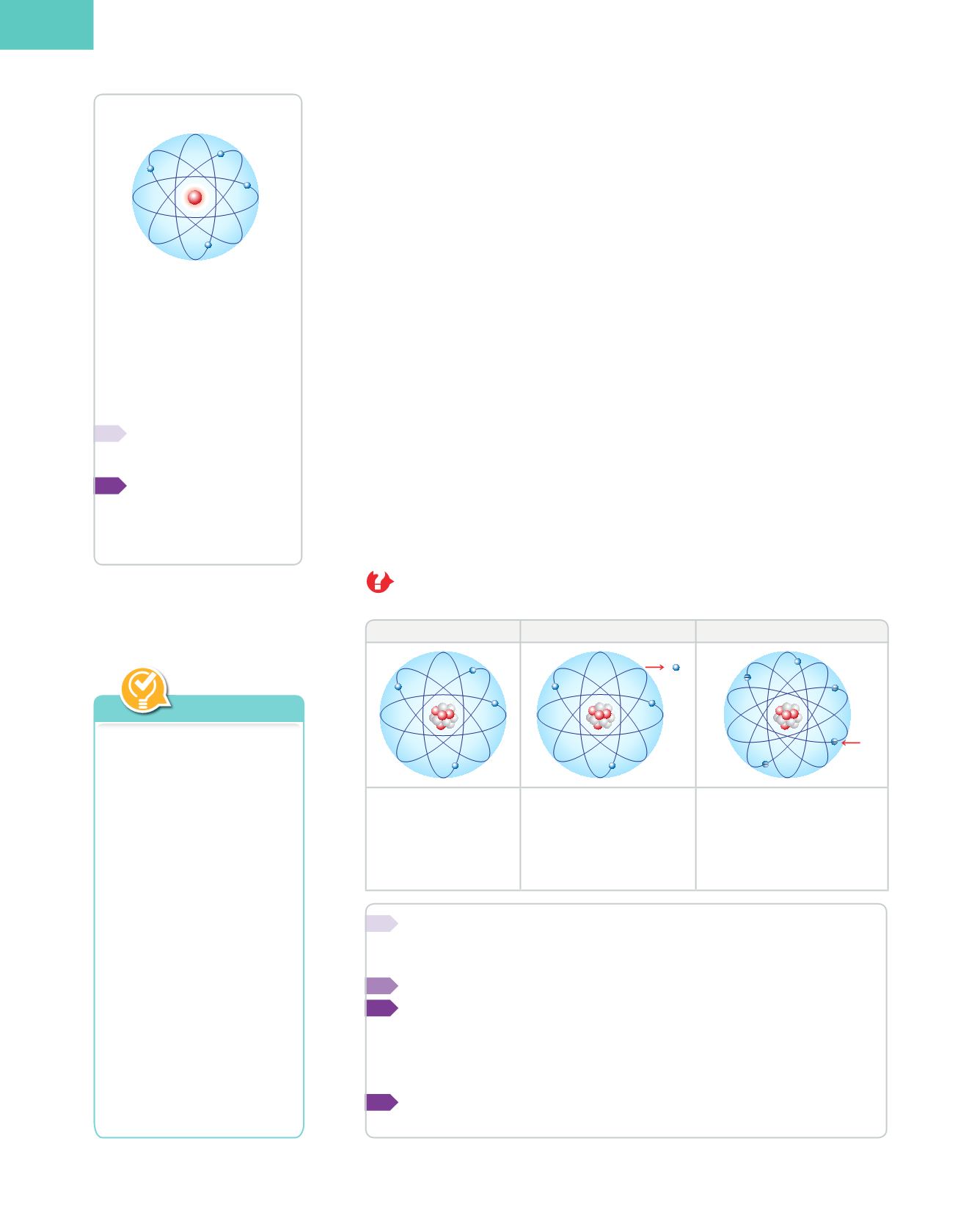
El model nuclear o planetari
Per a Rutherford, l’àtom estava constituït per:
❚❚
Un
nucli central,
amb càrrega positiva, en el qual està concentrada pràcticament
tota la massa, que aporten els
protons
i els
neutrons.
❚❚
Una
escorça electrònica
on els
electrons,
amb càrrega negativa, giren a molta
velocitat entorn del nucli i estan separats d’aquest per una gran distància en relació
amb la seua mida.
3.3.
La formació d’ions
En un àtom elèctricament neutre, el nucli conté tants protons com electrons hi ha en
l’escorça.
Què passa aleshores, quan un àtom elèctricament neutre perd un electró? I
què passa si el guanya?
Àtom neutre
Ió positiu o catió
Ió negatiu o anió
+
+ ++
–
–
–
–
+
+ ++
–
–
–
–
+
+ ++
–
Àtom
elèctricament
neutre
amb quatre
càrregues positives i
quatre de negatives.
Quan l’àtom
perd un
electró
es converteix en
un
ió positiu
o
catió.
En
l’exemple, amb quatre
càrregues positives i només
tres de negatives.
Quan l’àtom
guanya un
electró
es converteix en un
ió
negatiu
o
anió.
En l’exemple,
amb cinc càrregues negatives i
només quatre de positives.
Respon verdader o fals als enunciats següents i justifica les respostes.
a)
La massa del protó és inferior a la de l’electró.
b)
La massa del protó és superior a la del neutró.
Quantes vegades és més gran la massa del neutró que la de l’electró?
Si el diàmetre del nucli de l’àtom d’or mesura 10
−
12
cm i el de l’àtom sencer
10
−
8
cm.
a)
Quantes vegades és més gran la mida de l’àtom que la del nucli?
b)
D’acord amb aquest resultat, va estar encertat Rutherford quan va afirmar
que l’àtom constitueix un espai fonamentalment buit?
Compara el model de Thomson amb el model de Rutherford i estableix les
analogies i les diferències entre ambdós.
19
20
21
22
Model planetari de l’àtom
Rutherford pensava que hi ha-
via una certa similitud entre
l’estructura del sistema solar i
la de l’àtom, on els electrons
serien els planetes i el nucli, el
Sol. Va suposar que, igual que
els planetes giren al voltant del
Sol, els electrons ho deurien
fer al voltant del nucli.
Quants protons hi ha en
el nucli d’aquest àtom si és
elèctricament neutre
?
El dibuix del model atòmic
de Rutherford, l’han utilitzat
com a logo diverses institucions
relacionades amb l’energia atò-
mica. Localitza’n algunes
.
17
18


