76
Com s’identifiquen els àtoms?
28
Copia en el teu quadern i completa la frase següent:
«El nombre atòmic del coure, Cu, és 29, i el seu nombre
màssic és 64, la qual cosa vol dir que aquest àtom de coure
té _ protons i _ neutrons, i si és elèctricament neutre, té _
electrons.»
29
Representa els àtoms de cada un dels elements se-
güents:
❚❚
Oxigen, símbol O,
Z
=
8,
A
=
16.
❚❚
Nitrogen, símbol N,
Z
=
7,
A
=
14.
❚❚
Calci, símbol Ca,
Z
=
20,
A
=
40.
❚❚
Magnesi, símbol Mg, nombre de protons 12 i nombre de
neutrons 13.
❚❚
Brom, símbol Br, nombre de protons 35 i nombre de neu-
trons 45.
30
Determina el nombre de protons, neutrons i electrons
de:
a)
Un àtom de
65
30
Zn elèctricament neutre.
b)
Un ió
85
37
Rb
+
.
c)
Un ió
80
35
Br
−
.
d)
Un àtom de
81
35
Br elèctricament neutre.
e)
Un àtom de
205
82
Pb elèctricament neutre.
31
El nombre de neutrons del liti és un més que el de pro-
tons. Si sabem que el seu nombre màssic és 7:
a)
Quin és el seu nombre atòmic?
b)
Quants electrons té un àtom de liti elèctricament neu-
tre?
32
Pot un àtom de nombre atòmic 17 tenir com a isòtop
un altre àtom el nombre atòmic del qual siga 18? Jus-
tifica la resposta.
33
Coneixem les dades següents sobre els àtoms A, B, C i
D:
A
B
C
D
13 protons
14 neutrons
13 protons
13 neutrons
14 protons
15 neutrons
14 protons
15 neutrons
a)
Quins pertanyen a isòtops diferents del mateix ele-
ment?
b)
Quins pertanyen al mateix isòtop del mateix element?
c)
Són B i C àtoms del mateix element?
34
El nombre de neutrons del sodi és dos més que el de
protons. Si el seu nombre màssic és 23, quants elec-
trons tindrà?
35
Escriu el nombre de protons, neutrons i electrons de
cada un d’aquests àtoms:
a)
13
6
C
b)
26
56
Fe
c)
39
14
K
+
d)
16
8
O
2
−
Els nous models atòmics
36
Escriu i copia en el teu quadern l’opció correcta.
a)
Quan un àtom és excitat, alguns electrons poden passar
de nivells d’energia _ a d’altres d’energia _.
b)
Quan un electró emet energia és perquè ha passat d’un
nivell d’energia _ a un altre d’energia _.
37
Corregeix les afirmacions que siguen falses.
a)
El nivell energètic 2 pot contenir com a màxim 18 elec-
trons.
b)
El nivell energètic 1 pot contenir com a màxim 2 elec-
trons.
c)
El model atòmic de Rutherford no és vàlid, perquè qual-
sevol càrrega elèctrica que gire ha d’emetre radiació i açò
no passa.
d)
El primer postulat de Bohr afirma que l’electró es mou
al voltant del nucli en òrbites circulars, sense que hi haja
emissió d’energia.
e)
Segons Bohr, tots els electrons d’un àtom es troben en
un mateix nivell d’energia.
38
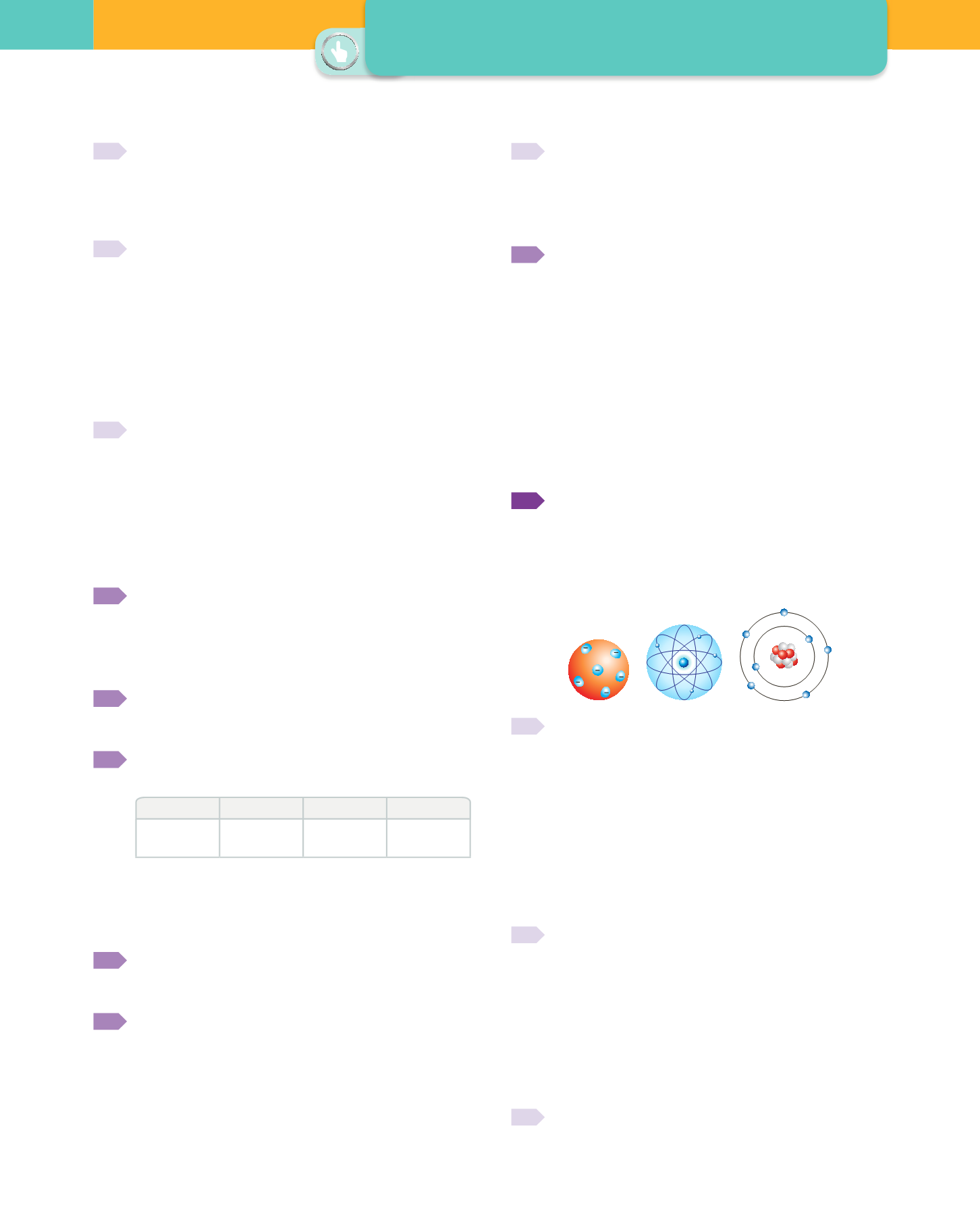
Respon a les qüestions següents relacionades amb els
models atòmics de Bohr, Thomson i Rutherford.
a)
Ordena cronològicament aquests models atòmics.
b)
Descriu breument les característiques de cada un dels
models.
c)
Associa cada model amb un dels dibuixos següents:
+
+
+
+
J.J. Thomson (1904)
(modelo pastel de pasas)
E. Rutherford (1909)
(modelo nuclear)
N. Bohr (1013)
(modelo niveles de energía)
39
Associa cada terme amb la definició corresponent:
nombre atòmic, isòtop, nucli atòmic, ió i neutró.
a)
El centre d’un àtom.
b)
Nombre de protons en un nucli.
c)
Partícula nuclear sense càrrega elèctrica.
d)
Àtom amb càrrega elèctrica.
e)
Àtoms d’un mateix element amb nombre diferent de
neutrons en el nucli.
Com dibuixar àtoms
40
Relaciona els àtoms següents: heli (2 electrons), fluor
(9 electrons), liti (3 electrons), sodi (11 electrons) i argó
(18 electrons) amb la configuració electrònica corres-
ponent:
a)
2 8 8
b)
2
c)
2 7
d)
2 1
e)
2 8 1
41
Dibuixa el nucli i els nivells d’energia d’un àtom de fòs-
for,
Z
=
15,
A
=
31.
EXERCICIS, ACTIVITATS I TASQUES
3


