70
3
5.
ELS NOUS MODELS ATÒMICS
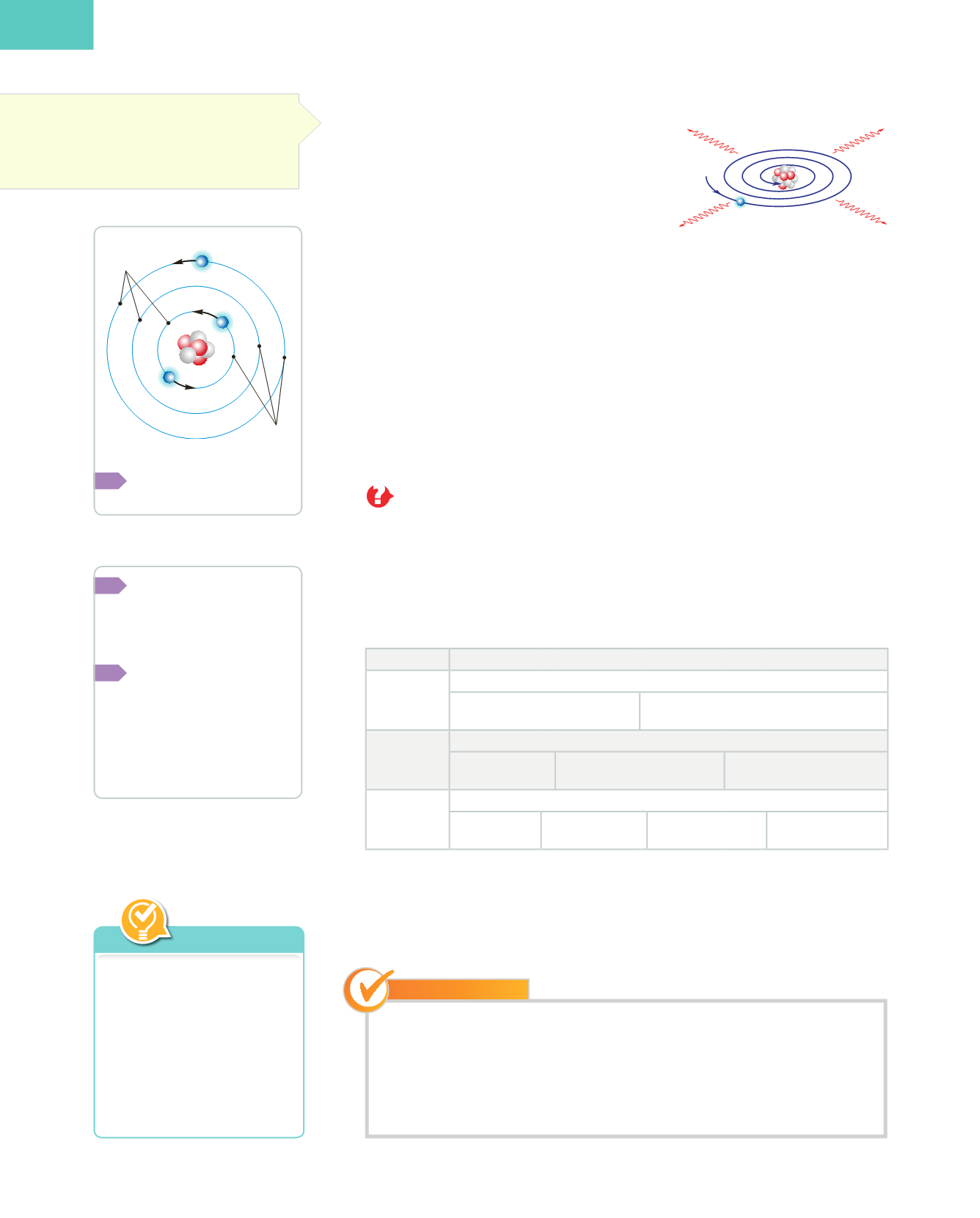
Segons el model de l’àtom nuclear o planetari,
els electrons giren a gran velocitat entorn del
nucli sense que sapiem a quina distància estan
del nucli. No obstant això, és un fet conegut que
qualsevol càrrega elèctrica que gire ha d’emetre
energia en forma de radiació. Si açò ocorregue-
ra, l’electró aniria perdent energia i s’acostaria
cada vegada més al nucli descrivint una
trajec-
tòria espiral,
i acabaria caient sobre aquest.
5.1.
El model dels nivells d’energia de Bohr
El 1913,
Niels Bohr
(1885-1962) va modificar el model atòmic de Rutherford mi-
tjançant els postulats següents:
1.
L’electró només es mou en unes òrbites circulars,
sense que hi haja emissió
d’energia.
L’electró, depenent de l’òrbita en què estiga, té una energia determina-
da, que és més gran com més allunyada estiga l’òrbita del nucli.
2.
L’emissió d’energia només es produeix quan un electró salta d’un nivell energètic
(òrbita) d’energia superior a un altre d’energia inferior.
Aleshores, com es distribueixen els electrons en aquests nivells?
5.2.
La distribució dels electrons
A partir de 1916 es van desenvolupar altres models atòmics per tractar d’explicar les
propietats químiques dels elements. Així, els científics van arribar a la conclusió que els
electrons estan distribuïts en
nivells
i
subnivells
d’energia que admeten un nombre
màxim d’electrons.
Nivell 1 (K)
Nombre màxim d’electrons: 2
Nivell 2 (L)
Nombre màxim d’electrons: 8
Subnivell 1
2 electrons
Subnivell 2
6 electrons
Nivell 3 (M)
Nombre màxim d’electrons: 18
Subnivell 1
2 electrons
Subnivell 2
6 electrons
Subnivell 3
10 electrons
Nivell 4 (N)
Nombre màxim d’electrons: 32
Subnivell 1
2 electrons
Subnivell 2
6 electrons
Subnivell 3
10 electrons
Subnivell 4
14 electrons
La distribució per nivells dels electrons d’un àtom d’un element rep el nom de
configu-
ració electrònica
de l’element.
Els electrons situats en l’últim nivell energètic d’un àtom s’anomenen
electrons de
valència,
i són els responsables de les propietats químiques de les substàncies, com
veurem en la pròxima unitat.
❚❚
L'àtom, segons Rutherford,
està format per un nucli amb
càrrega positiva al voltant del
qual giren els electrons, amb
càrrega negativa.
nivells
nucli
electró
òrbites
estables
1
2
3
–
–
–
Model atòmic de Bohr.
Què ocorre si l’electró del
nivell 3 passa al nivell 2
?
25
L’àtom de beril·li té 4 elec-
trons. Indica quina d’aquestes
configuracions electròniques és
la correcta
:
a)
2 2
b)
2 1 1
c)
1 1 1 1
L’àtom de potassi té
19 electrons. Indica quina
d’aquestes configuracions elec-
tròniques és la correcta
:
a)
2 2 6 2 6 1
b)
2 2 5 2 5 3
c)
2 8 8 1
26
27
3.
Escriu la configuració electrònica del Mg i del Mg
2+
.
❚
❚
El Mg té 12 electrons que cal distribuir en els diversos nivells i sub-
nivells.
❚
❚
La configuració electrònica del Mg és: 2 2 6 2
=
2
8 2
❚
❚
El Mg
2+
té dos electrons menys. La seua configuració és: 2 2 6
=
2 8
EXERCICI RESOLT
Idees clares
❚❚
Els
electrons
es distribueixen
al voltant del nucli en
nivells
i
subnivells
d’energia.
❚❚
Cada nivell i subnivell admet un
nombre màxim
d’electrons.
❚❚
La
configuració electrònica
és
una manera de representar la
distribució dels electrons d’un
àtom.
Energia emesa per l'electró.


