109
6. Les reaccions químiques
+
www
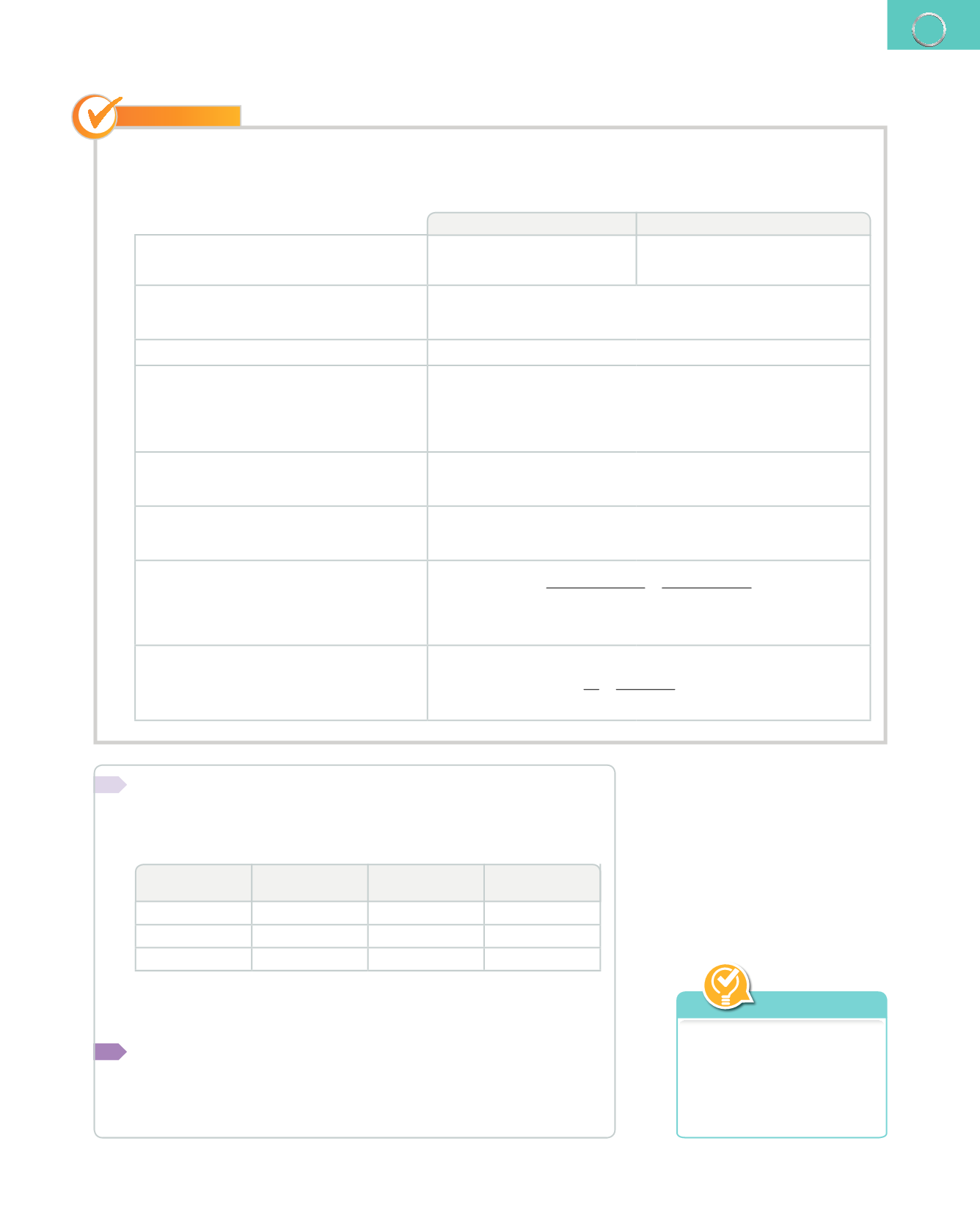
4.
Quan el carbonat de calci sòlid, CaCO
3
, reacciona amb l'àcid clorhídric, HCl, diluït, s'obtenen clorur de calci,
CaCl
2
, soluble, aigua líquida i diòxid de carboni, que es desprén en forma de gas. Calcula la quantitat de clorur
de calci que s'obté quan 50 g de carbonat de calci reaccionen amb la quantitat suficient d'àcid clorhídric.
Reactius
Productes
1.
S'identifiquen els reactius i els productes.
Carbonat de calci: CaCO
3
Àcid clorhídric: HCI
Clorur de calci: CaCl
2
; Aigua: H
2
O
Diòxid de carboni: CO
2
2.
S'escriu l'equació química, incloent-hi, a
més dels símbols i les fórmules, l'estat físic
de les substàncies.
CaCO
3
(s)
+
HCl (aq)
→
CaCl
2
(aq)
+
H
2
O (l)
+
CO
2
(g)
3.
S'ajusta o s'equilibra l'equació.
CaCO
3
(s)
+
2 HCl (aq)
→
CaCl
2
(aq)
+
H
2
O (l)
+
CO
2
(g)
4.
S'indica davall de cada component la
quantitat de substància, en mol. Aquest
nombre coincideix amb el que figura
davant de cada símbol o fórmula; si no hi
apareix indicat, es tracta d'1 mol.
CaCO
3
(s)
+
2 HCl (aq)
→
CaCl
2
(aq)
+
H
2
O (l)
+
CO
2
(g)
1 mol
2 mol
1 mol
1 mol 1 mol
5.
S'hi afig la massa atòmica relativa de
cada substància o la seua massa molecular
relativa.
CaCO
3
(s)
+
2 HCl (aq)
→
CaCl
2
(aq)
+
H
2
O (l)
+
CO
2
(g)
100
36,5
111
18
44
6.
S'escriuen les masses de les substàncies,
tenint en compte les quantitats relatives
que figuren en la equació.
CaCO
3
(s)
+
2 HCl (aq)
→
CaCl
2
(aq)
+
H
2
O (l)
+
CO
2
(g)
100 g 2
⋅
36,5
=
73 g 111 g
18 g
44 g
7.
S'estableix l'equivalència entre les
quantitats estequiomètriques
1
i les dades
de l'enunciat.
100 g de CaCO
3
50 g de CaCO
3
=
111 g de CaCl
2
x
g de CaCl
2
x
=
55,5 g de CaCl
2
8.
Es calcula la quantitat de substància, en
mol.
Amb 50 g de CaCO
3
s'obtenen 55,5 g de CaCl
2
, que són:
n
=
m
M
=
55,5 g
111g/mol
=
0,5 mol
EXERCICI RESOLT
El calci reacciona amb l'oxigen de l'aire per a donar òxid de calci (calç viva):
calci
+
oxigen
→
òxid de calci
Copia en el quadern i calcula
x, y, z
aplicant la llei de conservació de la
massa:
Experiment
Massa de
calci (g)
Massa d'oxigen
(g)
Massa d'òxid de
calci (g)
1
8
3,2
z
2
4
y
5,6
3
x
0,8
2,8
a)
Comprova que aquestes dades compleixen la llei de les proporcions cons-
tants.
b)
Calcula el percentatge de calci i d'oxigen en l'òxid de calci.
Tenim 3,07 g de magnesi que reaccionen exactament amb 2,02 g d'oxigen
per a formar òxid de magnesi. Quina quantitat d'òxid de magnesi se
n'obté? Calcula el percentatge d'oxigen i de magnesi en l'òxid de mag-
nesi.
Solució:
5,09 g, 0,126 mol; % de Mg
=
60,3%; % de O
=
39,7%
17
178
Idees clares
❚❚
Els
càlculs estequiomètrics
en una reacció química són
necessaris per a obtenir la
quantitat d'una substància
que reacciona o la quantitat
de substància obtinguda.
1
quantitat estequiomètrica:
la que ens
indiquen els coeficients que s'utilitzen
per a ajustar una equació química.


