4
Estructura atómica y molecular
104
Con los datos de abundancia relativa y masas atómicas, ha-
llamos el promedio:
Masa atómica
=
62,930
⋅
0,691
+
64,928
⋅
0,309
=
63,548 u
El valor obtenido corresponde al átomo de cobre (Cu).
20
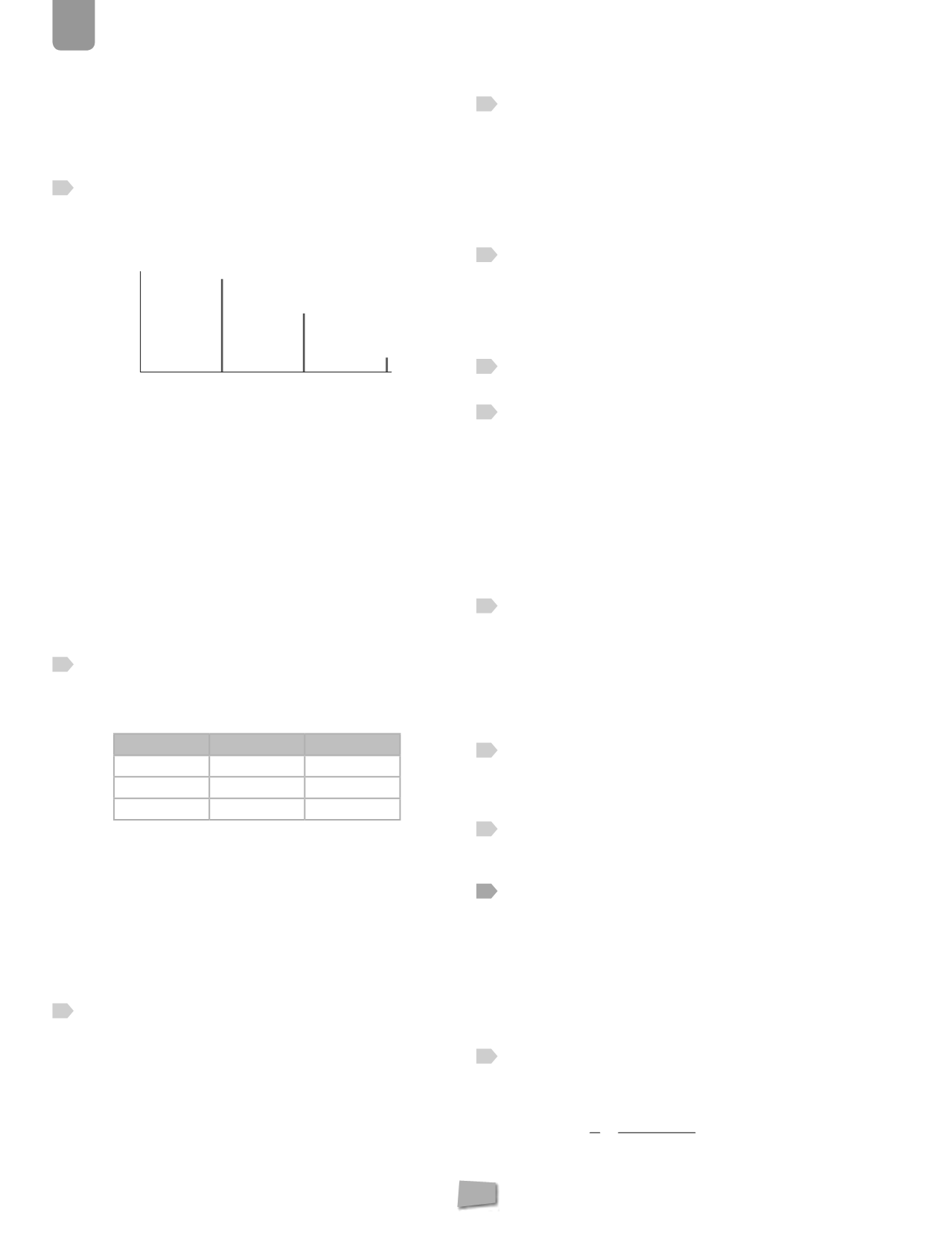
El espectrómetro de masas revela que el Cl tiene dos
isótopos, el
35
Cl (más abundante) y el
37
Cl; entonces,
¿cómo es posible que el espectrograma de masas del di-
cloro, además de mostrar picos a 35 y 37, muestre estos
tres de la figura?
100
50
68
69
70
71
72
73
74
70
72
74
m/Q
El cloro molecular (Cl
2
) es el resultado de la unión covalente
entre dos átomos de cloro, y como hay dos tipos de átomos
cloro, el Cl-35 (más abundante) y el Cl-37, existirán tres posi-
bles combinaciones:
❚
1.ª)
35
Cl -
35
Cl de masa molecular 70, y el más abundante
por contener al isótopo de mayor proporción.
❚
2.ª)
35
Cl -
37
Cl de masa 72 y de abundancia más o menos
intermedia.
❚
3.ª)
37
Cl -
37
Cl de masa 74 y el menos abundante por con-
tener a los dos isótopos menos abundantes.
La abundancia relativa de las tres moléculas se puede explicar
teniendo en cuenta la proporción en la que se encuentran los
dos isótopos.
21
El magnesio tiene tres isótopos naturales. La abundan-
cia y la masa de cada uno se han determinado por es-
pectrometría de masas y es la que aparece en la tabla
4.6. Calcula la masa atómica del magnesio.
Isótopo Abundancia
Masa (u)
24
Mg
78,99
23,98504
25
Mg
10,00
24,98584
26
Mg
11,01
25,98259
Masa atómica Mg
=
0,7899
⋅
23,98504 u
+
0,1000
⋅
24,98584 u
+
0,1101
⋅
25,98259 u
=
18,946 u
+
2,4986 u
+
+
2,8607 u
=
24,30 u (con cuatro cifras significativas).
Los dos isótopos más pesados contribuyen menos que el otro
debido a que la mayor parte de los átomos de magnesio (el
79%) corresponden al isótopo más ligero.
Los espectros. Hipótesis de Planck.
Efecto fotoeléctrico. Modelo de Bohr
22
Define los conceptos de longitud de onda, número de
onda y frecuencia de una radiación.
La
longitud de onda
es la distancia (en m, cm, Å, etc.) entre
dos puntos consecutivos de una onda que se hallan en el
mismo estado de vibración. El
número de onda
es la inversa
de la longitud de onda (se mide en cm
−
1
, m
−
1
, etc.). La
fre-
cuencia
es el número de ondas que pasan por un punto en
la unidad de tiempo; se mide en s
−
1
o, lo que es lo mismo, en
hertzios, Hz (en honor de Heinrich Rudolf Hertz).
23
¿Qué es el espectro visible? ¿En qué rango de frecuen-
cias se encuentra?
El espectro visible es la región del espectro electromagnético
que el ojo humano es capaz de percibir.
No hay límites exactos en el espectro visible, pues unas per-
sonas perciben una región más ancha y otras, menos ancha,
no obstante se ha establecido entre unas longitudes de onda
de 400 a 700 nm.
24
¿Qué diferencia hay entre el espectro de la luz visible y
el de la luz que emite una sustancia cuando arde o un
gas cuando se le excita?
El espectro de la luz visible es continuo, mientras que el que
emite una sustancia cuando arde (o un gas cuando se le ex-
cita mediante descargas) es discontinuo o de rayas.
25
¿Qué afirma la hipótesis de Planck?
Véase el epígrafe 4.1 del
Libro del alumno.
26
¿Cómo explica el modelo atómico de Bohr los espectros
atómicos? ¿Por qué hubo que hacer correcciones a este
modelo?
Al calentar un elemento gaseoso o cuando se le aplica una
descarga eléctrica, los electrones de sus átomos promocio-
nan a niveles superiores, con lo que su situación se torna
inestable, ya que existe un alto contenido energético; por
ello, cuando se retire la fuente energética, los electrones
volverán a su estado fundamental, emitiendo el exceso de
energía en forma de radiación que, pasada a través de un
polarímetro, dará lugar al espectro.
27
Si un gas excitado mediante calor o descargas eléctricas
deja una raya roja a 668 nm, ¿por qué cuando, sin estar
excitado, se interpone en el camino de un haz de luz
blanca, deja una raya negra a 668 nm sobre el fondo de
los siete colores?
En el primer caso emite luz roja de
λ
=
668 nm (espectro de
emisión), mientras que en el segundo absorbe luz roja (de
668 nm) de la blanca que le llega (espectro de absorción).
28
¿Cuáles de las siguientes líneas espectrales se encuentra
en la región visible del espectro: 300 nm, 500 nm,
700 nm o 900 nm?
La de 500 nm (verde) y la de 700 nm (rojo).
29
¿Qué son los microondas?
Las microondas son radiaciones electromagnéticas de baja
energía, frecuencia y, por tanto, baja longitud de onda.
30
Si excitamos todos los electrones de una muestra de
átomos de hidrógeno hasta el nivel 4, al volver a esta-
dos de energía inferiores, ¿cuántas líneas aparecerán
en el espectro de emisión resultante?
Sin tener en cuenta la estructura fina del espectro, serían 6
grandes líneas las que aparecerían en el espectro de emisión,
las correspondientes a las transiciones:
n
=
4
n
=
3;
n
=
4
n
=
2;
n
=
4
n
=
1;
n
=
3
n
=
2;
n
=
3
n
=
1;
n
=
2
n
=
1.
31
Averigua la longitud de onda de la radiación de fre-
cuencia 4,8
⋅
10
15
s
−
1
.
Aplicamos la siguiente relación:
λ
=
c
υ
=
3
⋅
10
8
m s
−
1
4,8
⋅
10
15
s
−
1
=
6,258
⋅
10
−
8
m


