4
Estructura atómica y molecular
106
Técnicas espectroscópicas
39
¿Cuál es el fundamento de la espectroscopia de absor-
ción atómica?
La espectroscopia de absorción atómica se fundamenta en la
propiedad que tienen los átomos de absorber radiación a longi-
tudes de onda muy específicas, esas para las cuales la diferen-
cia de energía entre los niveles electrónicos del átomo coincide
con la energía del fotón incidente. La cantidad de absorción
va a estar relacionada con la concentración de la especie ab-
sorbente y con el espesor de la celda que contiene la muestra.
40
En un espectrómetro de absorción atómica, ¿cuál es la
función del atomizador? ¿Y la del detector?
El
nebulizador-atomizador
pulveriza la muestra hasta lle-
varla a su forma atómica. Puede servir la llama originada por
un sistema combustible/oxidante (acetileno/aire o acetileno/
N
2
O). El
detector
capta la señal lumínica procedente del mo-
nocromador y la transforma en señal eléctrica. Se usan mucho
los fotomultiplicadores y los detectores de estado sólido CCD
(
Charge Coupled Device,
Dispositivo de Carga Acoplada).
41
¿Se puede usar la espectroscopia de absorción atómica
para determinar el tipo de moléculas contenidas en una
muestra?
Aunque sí puede utilizarse, la espectroscopia de absorción
atómica se usa casi exclusivamente para átomos. Para las
moléculas existe la espectroscopia de absorción molecular
UV-visible e IR.
42
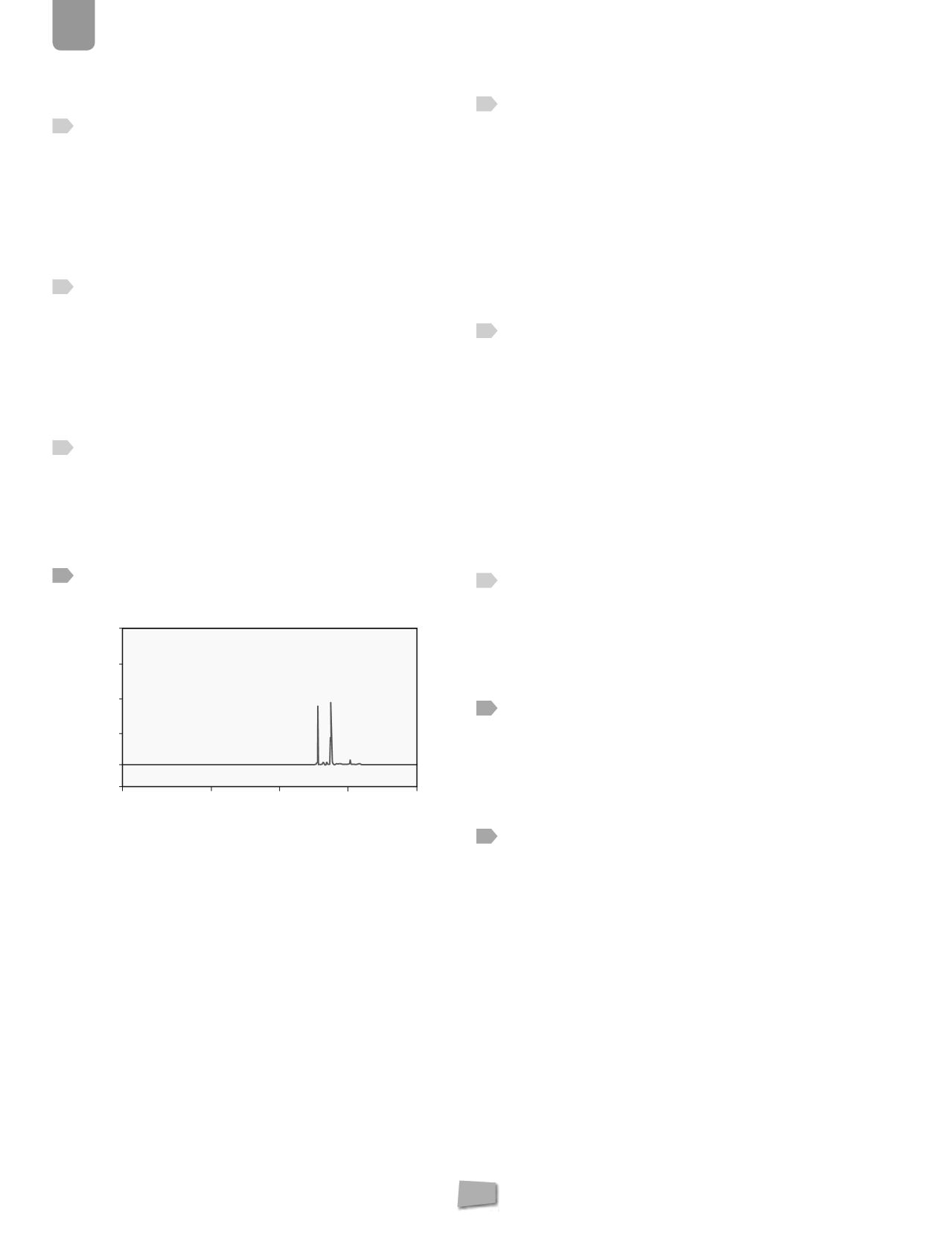
En un barrido espectral para determinar la longitud de
onda máxima a la que absorbe un analito, se obtuvo el
espectrograma de la figura.
2,00
1,50
1,00
0,50
0,00
-0,20
1850
2500
3000
3500
4000
Intensidad
Longitud de onda (nm)
Indica la veracidad o falsedad de las siguientes afirma-
ciones:
a)
El analito está formado por dos compuestos distin-
tos, de abundancia similar.
La absorción atómica determina fundamentalmente áto-
mos, por tanto esta afirmación solo podría ser verdadera
si los dos compuestos estuvieran formados, entre los dos,
por tan solo dos tipos distintos de átomos y que absorbie-
ran a la longitud de onda que muestra el espectrograma.
b)
El analito está formado por un solo elemento consti-
tuido por moléculas diatómicas homonucleares.
Podría ser verdadera solo en el caso de que el único ele-
mento que forma la molécula (homonuclear) contenga
dos isótopos de abundancia similar y que absorban a la
longitud de onda que muestra el espectrograma. Lo cual
restringe mucho las posibilidades de que sea verdadera.
c)
El analito contiene, mayoritariamente, dos tipos de
átomos de abundancia similar.
Verdadera, y por la cercanía de la absorción, serán isótopos.
43
Explica el fundamento de la espectroscopia IR.
Cuando se hace pasar radiación IR a través de una muestra,
la energía absorbida por la muestra está relacionada con la
frecuencia de vibración de los enlaces covalentes de las molé-
culas que la forman. Cuando la frecuencia de vibración de un
enlace coincide con alguna de las frecuencias de la radiación
incidente, se produce absorción. Como cada molécula tiene
modos de vibración específicos, los picos vienen a ser como
las «impresiones» que han dejado en el espectro IR los dife-
rentes enlaces de la molécula. De esta forma, analizando las
longitudes de onda (o números de onda) a las que absorbe
una muestra, podemos obtener información acerca de las
moléculas que la componen.
44
¿Qué se entiende por «modo de vibración» de una mo-
lécula? Indica las diferencias existentes entre vibración
de tensión y vibración de flexión.
Los modos de vibración de una molécula son los movimientos
específicos del conjunto de átomos que conforman la mo-
lécula. Se distinguen por las frecuencia (o números de onda)
de vibración de los enlaces covalentes que la componen. A
pesar de que las vibraciones son colectivas (vibra la molécula
entera), es posible distinguir dos formas básicas de vibración:
tensión
(
stretching
) y
flexión
(
bending
).
Las vibraciones de
tensión
o
alargamiento
se deben a cam-
bios en la distancia interatómica a lo largo del eje del enlace
entre dos átomos, mientras que las de
flexión
se deben a
cambios en el ángulo que forman dos enlaces.
45
Indica el número de modos de vibración de las siguien-
tes moléculas:
a)
CO
b)
SH
2
c)
O
3
d)
NH
3
a)
Modos de vibración de CO: uno (de tensión).
b)
SH
2
: 3
n
−
6
=
3
⋅
3
−
6
=
3 modos de vibración.
c)
O
3
: 3
n
−
6
=
3
⋅
3
−
6
=
3 modos de vibración.
d)
NH
3
: 3
n
−
6
=
3
⋅
4
−
6
=
6 modos de vibración.
46
Razona si las siguientes moléculas absorberán luz infra-
rroja debido a sus movimientos vibracionales internos:
a)
CCl
4
b)
CO
c)
Cl
2
d)
H
2
e)
NO
f)
O
3
Todas absorberán luz infrarroja excepto H
2
y Cl
2
, que al ser
diatómicas homonucleares, y por tanto no polares, la tensión
del único enlace (única vibración posible) no puede alterar el
momento dipolar, que de por sí ya es nulo.
47
Indica si las siguientes afirmaciones son verdaderas o
falsas:
a)
Un espectro IR es la representación gráfica de la ab-
sorción de energía (por parte de una muestra des-
pués de incidir sobre ella un haz de luz IR) frente a
la frecuencia, longitud de onda o número de onda
de dicha luz.
Verdadera.
b)
Cuando la frecuencia de la luz incidente es resonan-
te con la frecuencia de la vibración de un enlace, la
luz es absorbida.
Verdadera. Aquí
resonante
es sinónimo de
coincidente
.
c)
Puede haber dos moléculas distintas cuyos espectros
IR sean idénticos.
Falso. Pues cada molécula tiene modos de vibración es-
pecíficos. Se le puede decir a los alumnos que hay una
excepción: dos enantiómeros sí pueden tenerlos, como
podrán comprobar en la U
NIDAD
8.


