Análisis de llama
103
Estructura atómica y molecular
4
TÉCNICAS DE TRABAJO Y EXPERIMENTACIÓN
Los vapores de ciertos metales dan un color característico a la llama incolora que sale
de un mechero Bunsen. La llama excita los átomos del metal y lleva a los electrones
del nivel exterior a niveles superiores (que están vacíos). Enseguida, el electrón des-
ciende, bien directamente o a través de saltos intermedios, hasta regresar al nivel
de partida. En cada salto el átomo emite el fotón correspondiente a la diferencia de
niveles de energía. El color en la llama lo causan estas emisiones de radiación, que
al ser de baja frecuencia, ya que corresponden a diferencias de energía entre niveles
bastantes alejados del núcleo, se encuentran en la zona del visible o muy próxima a
él; de ahí que se «vea» el color.
Para un elemento particular, la coloración de la llama es siempre la misma, indepen-
dientemente de si dicho elemento se encuentra en estado libre o combinado con
otros (los cloruros se encuentran entre los compuestos más volátiles). Esta propiedad
permite su identificación.
❚❚
Observar y diferenciar distintos elementos metálicos según la luz que
emiten al ser calentados mediante la llama de un mechero Bunsen.
Objetivo
Material necesario
❚❚
Hilo de platino o nicrom con mango de madera o vidrio.
❚❚
Mechero Bunsen.
❚❚
Ocho vidrios de reloj.
❚❚
Pequeñas cantidades de las siguientes sales: LiCl, NaCl, KCl, SrCl
2
,
BaCl
2
, CaCl
2
y KBr.
❚❚
HCl concentrado.
Procedimiento
1.
En ocho vidrios de reloj deposita unos cristales de cada una de las sales anteriores y en el octavo unas gotas de HCl concen-
trado.
2.
Humedece el hilo en HCl y recoge una pequeña muestra de la primera sustancia (tocándola). A continuación, pon el hilo,
impregnado en sal, en contacto con la llama oxidante inferior de un mechero Bunsen.
3.
Anota el color de la llama.
4.
Limpia bien el hilo (humedeciéndolo en HCl) y repite el mismo procedimiento con las otras sales. Construye una tabla que
recoja tus observaciones.
Sal
Observaciones
…
…
…
…
…
…
5.
Si dispones de un espectroscopio o una red de difracción, observa la luz emitida por la llama.
1
¿El color de la llama se debe al elemento metálico o al halógeno? ¿Qué ensayo de los realizados te ha conducido a esa
conclusión?
2
¿A qué se debe el color de cada llama? ¿Por qué es necesario limpiar el hilo después de cada prueba?
3
Elabora un informe de la práctica.
Cuestiones
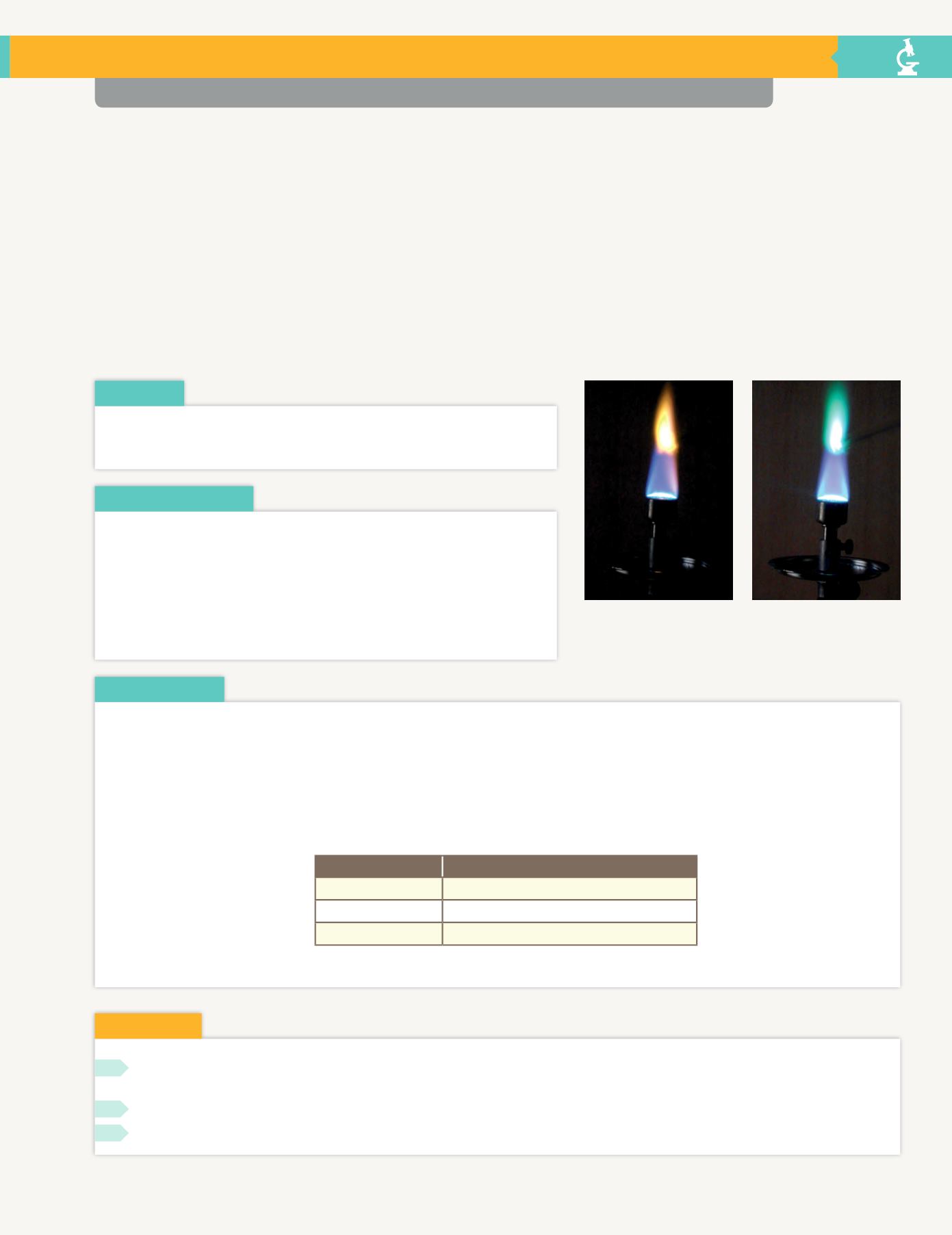
Figura 4.33.
a) Luz emitida por una sal de sodio. b) Luz
emitida por una sal de cobre.
a)
b)


