99
Estructura atómica y molecular
5.2.
Espectroscopia de absorción molecular infrarroja
La
espectroscopia infrarroja
(IR) es un tipo de espectroscopia de absorción que
utiliza la región infrarroja del espectro electromagnético como medio para iden-
tificar la composición molecular de una muestra.
La ventaja del IR frente al visible y al ultravioleta (UV) es que las absorciones que se
producen en el IR implican energías más pequeñas que las involucradas en las otras
dos regiones.
Como la región infrarroja es extensa (comprende números de onda que van desde
12800 cm
−
1
a 10 cm
−
1
), la espectroscopia IR se divide en tres zonas: IR cercano (NIR):
12800-4000 cm
−
1
; IR medio: 4000-400 cm
−
1
; e IR lejano: 400-10 cm
−
1
, siendo en el
IR cercano y, sobre todo, en el IR medio, donde se dan la mayoría de las aplicaciones
analíticas.
Por motivos históricos, la magnitud que más se usa en espectroscopia IR es el núme-
ro de onda (
υ
=
1/
λ
).
Un espectro IR (serie de picos que aparecen a determinados
υ
) se consigue hacien-
do pasar radiación IR (de cualquiera de las zonas antes mencionadas) a través de
una muestra y midiendo, a continuación, la fracción de esa radiación que ha sido
absorbida por la muestra.
La energía absorbida por la muestra está relacionada con
la frecuencia
de vibración de los enlaces covalentes
de las
moléculas
que la forman.
Cuando la frecuencia de vibración de un enlace coincide con alguna de las
frecuencias de la radiación incidente, se produce absorción.
Es como si la molécula tuviera
niveles discretos de energía,
que son los únicos que
acepta de toda la energía radiante que le llega.
Los picos que salen en el espectro corresponden a la cantidad de energía absorbida,
medida en unidades de transmitancia o absorbancia, en función del número de
onda (figuras 4.23 y 4.24).
Como cada molécula tiene
modos de vibración
específicos, los picos vienen a ser como las «im-
presiones» que han dejado en el espectro IR los
diferentes enlaces de la molécula.
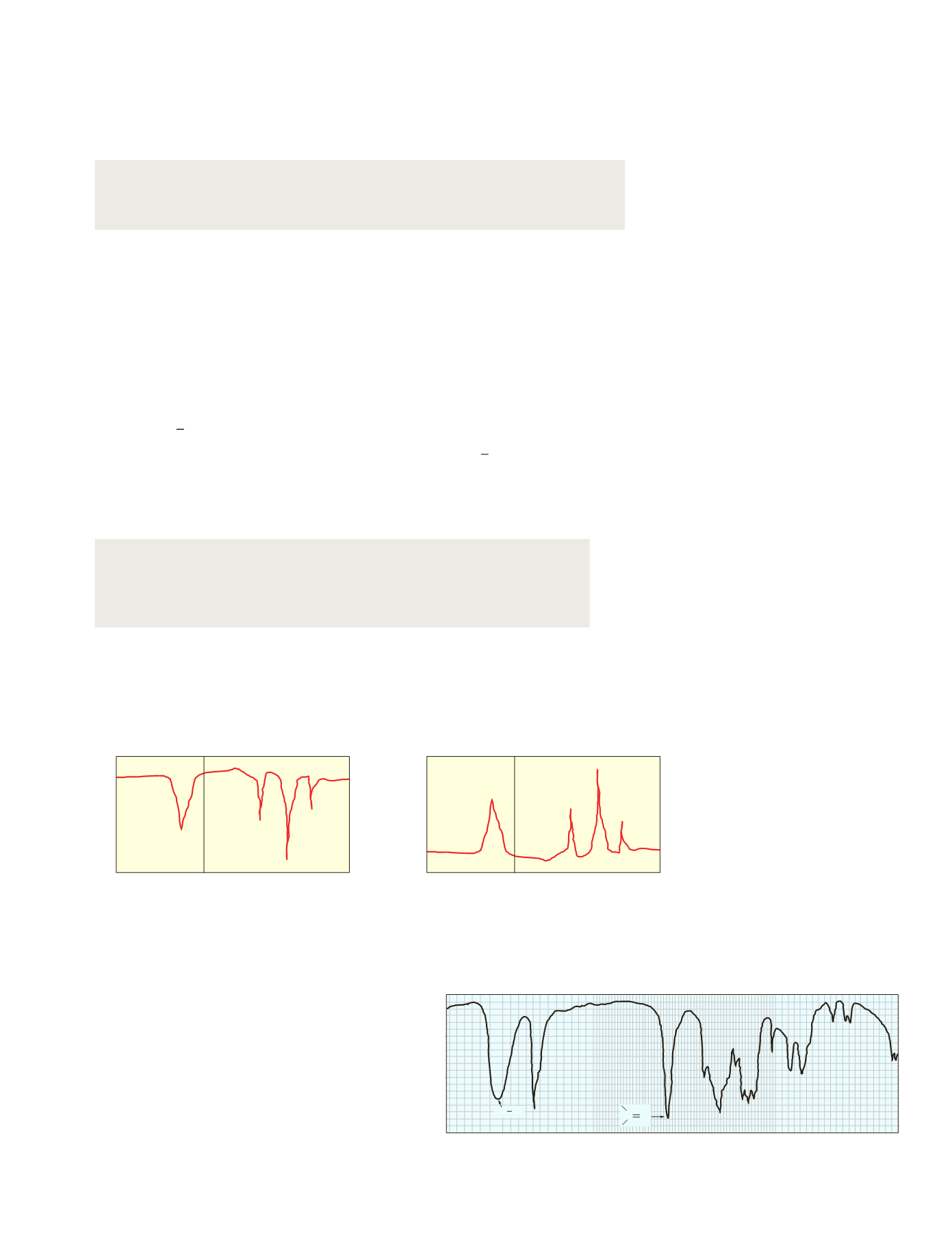
Para identificar la sustancia se compara su espectro
con el de otras moléculas conocidas (figura 4.25).
De esta forma, analizando las longitudes de onda
(o números de onda) que absorbe una muestra,
podemos obtener información acerca de las molé-
culas que la componen.
Figura 4.23.
Espectro IR de transmitancia (la transmitancia
mide la relación entre la cantidad de luz transmitida por
la muestra y la cantidad de luz que incidió sobre ella).
3000
cm
−
1
1000
cm
−
1
500
cm
−
1
T
Figura 4.24.
Espectro IR de absorbancia de la misma sustancia
que la de la figura 4.23. La absorbancia está relacionada con
la transmitancia, según la ecuación:
A
=
log 1/
T
.
3000
cm
−
1
1000
cm
−
1
500
cm
−
1
A
Figura 4.25.
Espectro IR de un compuesto orgánico.
HO
OC
0
100


