101
Estructura atómica y molecular
A continuación vamos a citar dos ejemplos que muestran lo expuesto anteriormente:
❚❚
La molécula H
2
O
es
angular
O
H H
y está formada por
tres átomos
, por lo que
tendrá: 3
⋅
3
−
6
=
3
modos normales de vibración, que corresponden a movimientos
específicos del conjunto de átomos que conforman la molécula, independientes
unos de otros y con su frecuencia de vibración característica. Los dos enlaces O–H
darán lugar a
2
modos de vibración de la clase
tensión
(uno simétrico y otro
asimétrico), y el único ángulo que tiene la molécula generará
1
único modo de
flexión.
Las frecuencias de vibración de los dos modos de tensión son parecidas
(3652 cm
−
1
y 3756 cm
−
1
), ya que en ambos casos se estira el mismo tipo de enlace
(el de flexión se da a 1595 cm
−
1
) (figura 4.29).
❚❚
La molécula CO
2
es
lineal
(
CO O
) y está formada por
tres átomos,
por lo que
tendrá: 3
⋅
3
−
5
=
4
modos normales de vibración. Dos serán de tensión (el núme-
ro de vibraciones de tensión suele coincidir con el de enlaces) y los otros dos de
flexión (figura 4.30). En el modo de tensión simétrica (el enlace se alarga y se acorta
simultáneamente), la molécula no absorbe luz IR, pues durante la vibración no hay
cambio en su momento dipolar (
µ
=
0); en los otros tres sí puede producirse tal
absorción, ya que los centros de carga varían a lo largo de la vibración (momento
dipolar oscilante). Sin embargo, los dos modos de flexión, al ser degenerados en
energía (las dos vibraciones son energéticamente indistinguibles), aparecen en el
espectro como una sola señal (figura 4.31 y tabla 4.5).
El instrumental usado en espectroscopia IR es similar al utilizado en AA. Permite
la irradiación de todas las longitudes de onda del IR, lo que revierte en un menor
tiempo de análisis; además, los actuales equipos son muy ligeros y se pueden trans-
portar allí donde se necesiten.
Por otra parte, el tipo de muestra (gaseosa, líquida o sólida) y su cantidad (si es sólida
basta con 1 mg y si es líquida, con una concentración entre 0,1 y 10%) tampoco
son inconvenientes, de ahí que las
aplicaciones
de esta técnica sean innumerables
tanto en las industrias farmacéutica, alimentaria, de la construcción, petroquímica,
etc., como en investigación científica, para controlar la calidad de alimentos y be-
bidas, medir las sustancias tóxicas existentes en el organismo, analizar cualitativa y
cuantitativamente los contaminantes del aire, el agua y el suelo.
Intervalo
de
υ
Enlace Tipo de vibración
3600-3200 O-H
Tensión
3500-3200 N-H
Tensión
3000-2800 C-H
Tensión
1600-1700 O-H
Flexión
1640-1550 N-H
Flexión
1400-1200 C-H
Flexión
1350-1000 C-N
Flexión
Tabla 4.5.
Es en la zona del IR medio donde
aparecen las bandas de absorción causadas
por las vibraciones entre únicamente dos
átomos de la molécula. De 2300 a 2000 cm
−
1
,
tensión de C
≡
C y C
≡
N. De 2000 a 1500 cm
−
1
,
tensión de C
=
O y C
=
C. De 1500 a 600 cm
−
1
(zona de la huella dactilar), flexión de O-H,
N-H, C-H, etcétera.
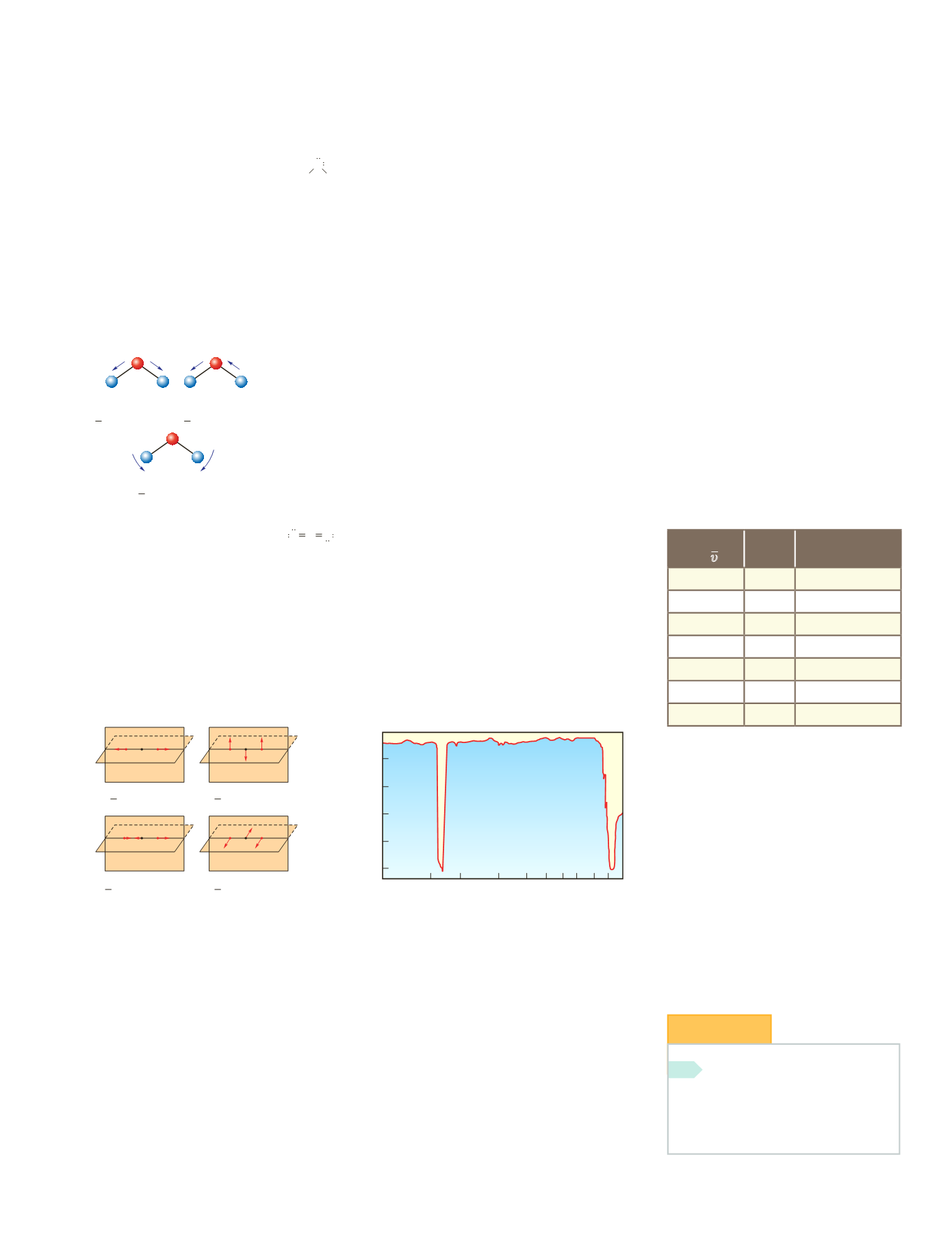
Tensión simétrica Flexión asimétrica
Tensión asimétrica Flexión simétrica
O O
O OC
O
C
ν
=
667 cm
−
1
ν
=
2349 cm
−
1
ν
=
667 cm
−
1
O
C
O OC
ν
=
1430 cm
−
1
Figura 4.30.
Modos de vibración de la
molécula CO
2
.
100
80
60
40
20
0
2349
667
T
Número de onda (cm
−
1
)
Figura 4.31.
Espectro de absorción IR del CO
2
.
Actividades
15
Averigua si las siguientes
moléculas absorberán luz IR de-
bido a sus movimientos vibracio-
nales internos:
a)
H
2
;
b)
O
3
;
c)
Br
2
;
d)
CCl
4
y
e)
NO.
Figura 4.29.
Los tres modos normales de
vibración del H
2
O. La vibración global de la
molécula es una combinación de los tres.
O
O
H
H
O
H
H H
H
Vibraciones en las
longitudes de enlace
Vibración del ángulo
de enlace
tensión simétrica tensión asimétrica
flexión
ν
1
=
3652 cm
−
1
ν
3
=
1595 cm
−
1
ν
2
=
3756 cm
−
1


