100
Unidad 4
Formas de vibración molecular
Los átomos que componen una molécula están unidos entre sí por fuerzas electros-
táticas que semejan uniones elásticas (figura 4.26).
La absorción de radiación infrarroja de cierta frecuencia, al activar la molécula des-
de un estado fundamental hasta otro excitado (al igual que ocurre en los átomos),
consigue que los grupos de átomos que la forman vibren (con movimiento armónico
simple y de manera independiente unos de otros) alrededor de la distancia intera-
tómica media.
A pesar de que las vibraciones son colectivas (vibra la molécula entera), es posible
distinguir dos formas básicas de vibración:
tensión
(
stretching
) y
flexión
(
bending
).
❚❚
Las
vibraciones de tensión
o
alargamiento
se deben a cambios en la distan-
cia interatómica a lo largo del eje del enlace entre dos átomos.
❚❚
Las
vibraciones de flexión
se deben a cambios en el ángulo que forman dos
enlaces (figura 4.27).
H
+ + –
+
Tensión
simétrica
Tensión
asimétrica
Flexión
tijera
Flexión
balanceo
Flexión
torsión
Flexión
aleteo
H H H H H H H H H H H
C
C
C C
C
C
Figura 4.27.
Modos de vibración molecular.
Ambas formas básicas de vibración (tensión y flexión) están
cuantizadas
y, por
tanto, pueden dejar
picos
o
bandas
en el espectro IR a las longitudes de onda (o
números de onda) en que se produce la absorción de energía.
Pero para que el pico sea observable, la absorción de energía debe producir algún
tipo de cambio en la molécula, como por ejemplo en su momento dipolar (
µ
).
De ahí que la espectroscopia IR no sirva para detectar
moléculas diatómicas homo-
nucleares
del tipo Cl
2
, O
2
, N
2
, ya que, al ser apolares (
µ
=
0), la
tensión
del único
enlace (única vibración posible) no puede alterar el momento dipolar nulo. Para
detectarlas se usa la espectroscopia Raman.
El resto de
moléculas diatómicas
(C
≡
0, H–Cl…), al tener un
solo enlace, presentan
una única
vibración, la de
tensión
(figu-
ra 4.26), a resultas de la cual cambia el momento dipolar de la
molécula, ya que
µ
puede ser mayor en la fase alargada que en
la comprimida, o al revés (momento dipolar oscilante). En su es-
pectro se apreciará una sola banda de absorción principal (figura
4.28 y tabla 4.4).
Para
moléculas poliatómicas
(constituidas por
n
átomos) la
cuestión es más compleja. En un principio podemos suponer que
cada átomo gozará de tres modos de vibración, que corresponden a los desplaza-
mientos a lo largo de las tres direcciones espaciales, por lo que la molécula, en su
conjunto, tendrá 3
n
modos de vibración. Sin embargo, tres de ellos no se pueden
adscribir al movimiento interno de dichos átomos, ya que corresponden a los tres
movimientos de traslación de la propia molécula, y otros tres más (dos, en el caso
de las moléculas lineales) incumben a los movimientos de rotación de la molécula.
En resumen:
Una molécula poliatómica formada por
n
átomos tiene
3
n
−
6
modos de vi-
bración (
3
n
−
5
cuando es lineal), por lo que en su espectro IR deben aparecer
3
n
−
6 bandas de tensión y flexión (3
n
−
5 cuando sea lineal).
Moléculas
υ
de la banda principal
de absorción (cm
−
1
)
HF
2907
HCl
2886
HBr
2559
HI
2230
Tabla 4.4.
En general, cuanto más fuerte o
rígido es un enlace, mayor es la frecuencia a
la que aparece el pico.
Se define el
momento dipolar
de
una molécula mediante la expre-
sión:
µ
=
Q
iónica
r
, donde
Q
iónica
es
la carga parcial iónica (
δ
−
o
δ
+
) de
cada átomo, y
r
el vector que une
el polo positivo con el negativo.
Si
Q
se expresa en culombios y
r
en metros, el momento dipo-
lar se especifica en Cm; si bien,
con mucha frecuencia, se utiliza
el debye (D), un submúltiplo que
equivale a 3,338
⋅
10
−
30
Cm.
DEFINICIÓN
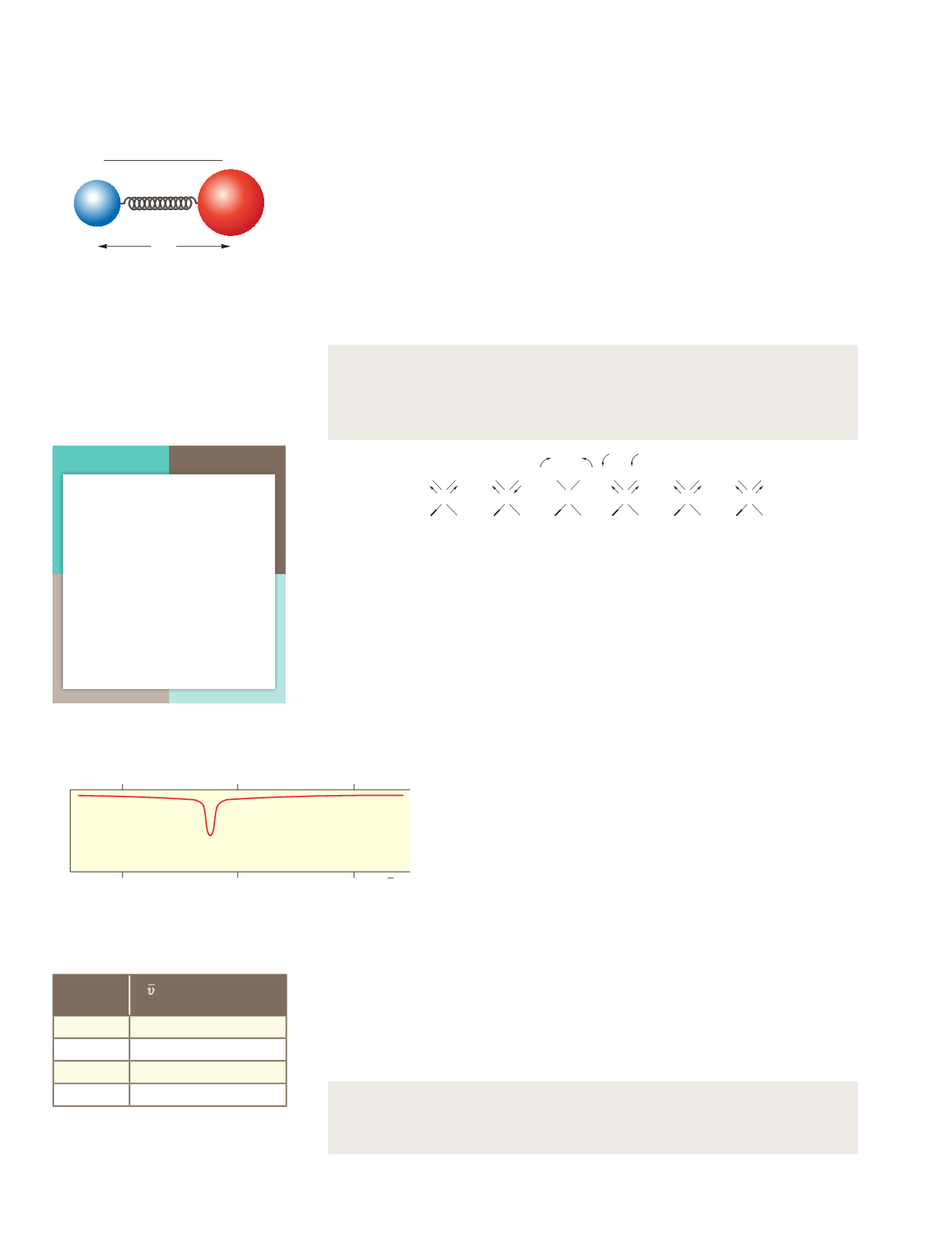
Figura 4.26.
Debido a los movimientos
vibracionales interatómicos, la unión entre
átomos puede considerarse de tipo elástico.
En la figura se muestra la vibración de
tensión existente en la molécula de HCl.
H
CI
3 000
2 000
4 000
ν
, cm
−
1
2 886 cm
−
1
5
×
10
−
4
3,3
×
10
−
4
2,5
×
10
−
4
λ
, cm
% de transmisión
Figura 4.28.
Espectro IR de moléculas de HCl (muestra una única banda
de absorción a 2886 cm
−
1
).


