107
Estructura atómica y molecular
ACTIVIDADES Y TAREAS
4
27
Si un gas excitado mediante calor o descargas eléc-
tricas deja una raya roja a 668 nm, ¿por qué cuando,
sin estar excitado, se interpone en el camino de un
haz de luz blanca, deja una raya negra a 668 nm
sobre el fondo de los siete colores?
28
¿Cuáles de las siguientes líneas espectrales se en-
cuentra en la región visible del espectro: 300 nm,
500 nm, 700 nm o 900 nm?
29
¿Qué son los microondas?
30
Si excitamos todos los electrones de una muestra
de átomos de hidrógeno hasta el nivel 4, al volver a
estados de energía inferiores, ¿cuántas líneas apare-
cerán en el espectro de emisión resultante?
31
Averigua la longitud de onda de la radiación de
frecuencia 4,8
⋅
10
15
s
−
1
.
Solucion:
6,258
⋅
10
−
8
m
32
Calcula la energía del fotón correspondiente a una
radiación de frecuencia 6
⋅
10
14
s
−
1
. Determina la lon-
gitud de onda de esa radiación.
Solucion:
3,98
⋅
10
−
19
J; 500 nm
33
Los rayos X tienen una longitud de onda que oscila
entre 10
-3
nm y 10 nm. Halla la energía correspon-
diente e intenta averiguar por qué se llama pene-
trantes a los primeros y blandos a los segundos.
Solucion:
E
1
=
1,99
⋅
10
−
13
J; E
2
=
1,99
⋅
10
−
17
J
34
Calcula la frecuencia de la radiación electromagnéti-
ca que emite un electrón cuando realiza en un áto-
mo el salto mostrado en la figura. ¿En qué parte del
espectro electromagnético dejará marca?
14,45 eV
e
−
10,22 eV
Solucion:
1,02
⋅
10
15
s
−
1
35
Calcula la frecuencia y longitud de onda del fotón
emitido por el tránsito del electrón del átomo de
hidrógeno del nivel 3 al nivel 2, sabiendo que entre
ellos hay una diferencia de energía de 1,89 eV.
Dato: 1 eV
=
1,6
⋅
10
−
19
J
Solucion:
4,56
⋅
10
14
s
−
1
; 6,58
⋅
10
−
7
m
36
Calcula la longitud de onda (en nm) que debe tener
una luz para que, al iluminar con ella una placa
de metal, esta emita electrones a una velocidad de
6,83
⋅
10
5
m/s.
Datos:
m
e
=
9,1
⋅
10
−
31
kg;
υ
0
metal
=
8
⋅
10
13
s
−
1
.
Solucion:
750 nm
37
Realiza un resumen de los distintos modelos atómi-
cos (ideas introducidas, hechos que explica y hechos
que no explica).
38
¿Cuál es la diferencia entre órbita y orbital?
Técnicas espectroscópicas
39
¿Cuál es el fundamento de la espectroscopia de
absorción atómica?
40
En un espectrómetro de absorción atómica, ¿cuál es
la función del atomizador? ¿Y la del detector?
41
¿Se puede usar la espectroscopia de absorción ató-
mica para determinar el tipo de moléculas conteni-
das en una muestra?
42
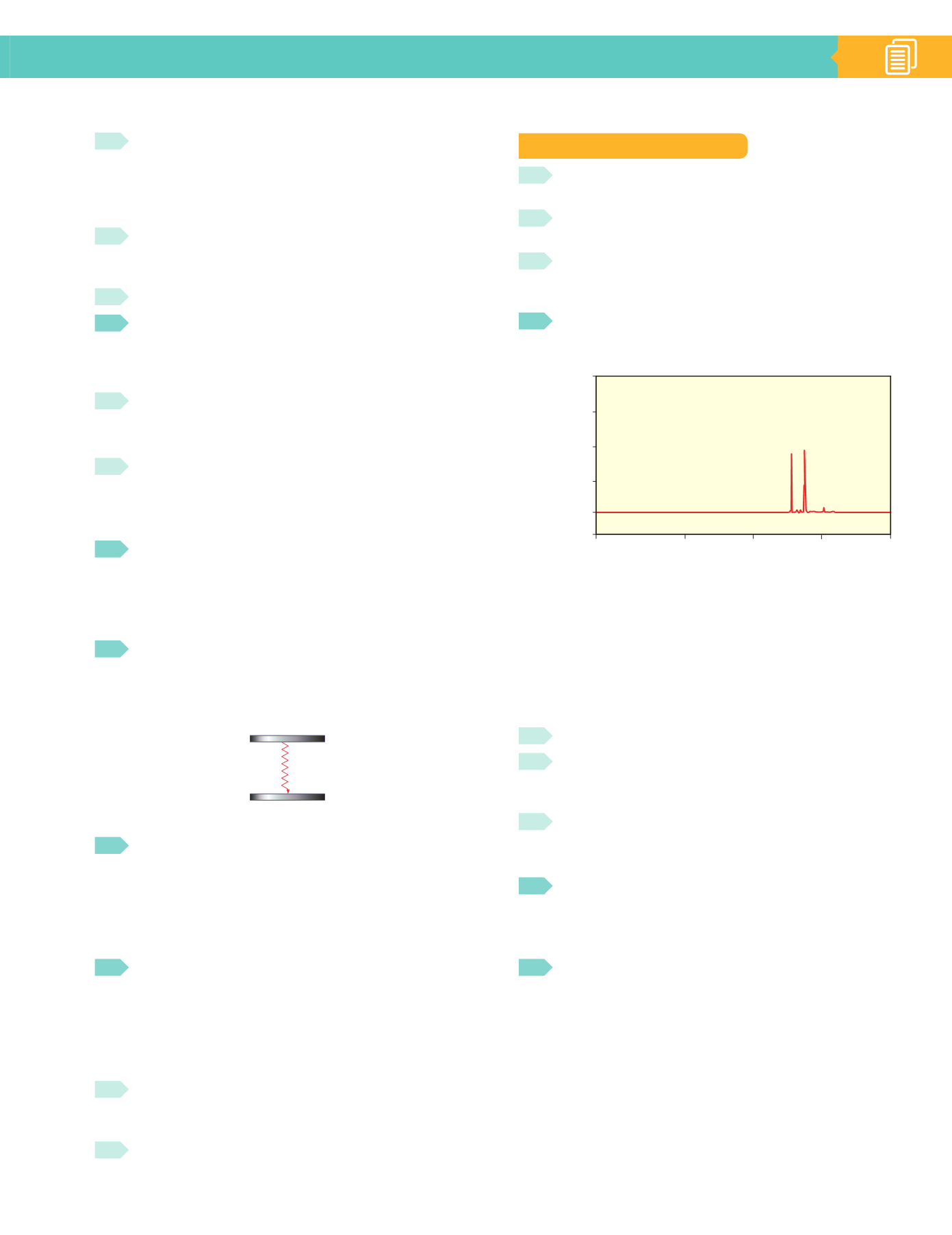
En un barrido espectral para determinar la longi-
tud de onda máxima a la que absorbe un analito, se
obtuvo el espectrograma de la figura.
2,00
1,50
1,00
0,50
0,00
-0,20
1850
2500
3000
3500
4000
Intensidad
Longitud de onda (nm)
Indica la veracidad o falsedad de las siguientes afir-
maciones:
a)
El analito está formado por dos compuestos distintos,
de abundancia similar.
b)
El analito está formado por un solo elemento consti-
tuido por moléculas diatómicas homonucleares.
c)
El analito contiene, mayoritariamente, dos tipos de
átomos de abundancia similar.
43
Explica el fundamento de la espectroscopia IR.
44
¿Qué se entiende por «modo de vibración» de una
molécula? Indica las diferencias existentes entre vi-
bración de tensión y vibración de flexión.
45
Indica el número de modos de vibración de las si-
guientes moléculas:
a)
CO
b)
SH
2
c)
O
3
d)
NH
3
46
Razona si las siguientes moléculas absorberán luz
infrarroja debido a sus movimientos vibracionales
internos:
a)
CCl
4
b)
CO
c)
Cl
2
d)
H
2
e)
NO
f)
O
3
47
Indica si las siguientes afirmaciones son verdaderas
o falsas:
a)
Un espectro IR es la representación gráfica de la absor-
ción de energía (por parte de una muestra después de
incidir sobre ella un haz de luz IR) frente a la frecuen-
cia, longitud de onda o número de onda de dicha luz.
b)
Cuando la frecuencia de la luz incidente es resonante
con la frecuencia de la vibración de un enlace, la luz
es absorbida.
c)
Puede haber dos moléculas distintas cuyos espectros
IR sean idénticos.


