124
TÉCNICAS DE TRABAJO Y EXPERIMENTACIÓN
6
Comprobación de la ley de conservación de la masa
❚❚
Una balanza digital.
❚❚
Un erlenmeyer.
❚❚
Un tubo de ensayo pequeño.
❚❚
Un globo.
❚❚
Carbonato de calcio molido.
❚❚
Ácido clorhídrico 1 M.
Materiales
1.
Pesa en una balanza unos 0,4 g de CaCO
3
en el erlenmeyer.
2.
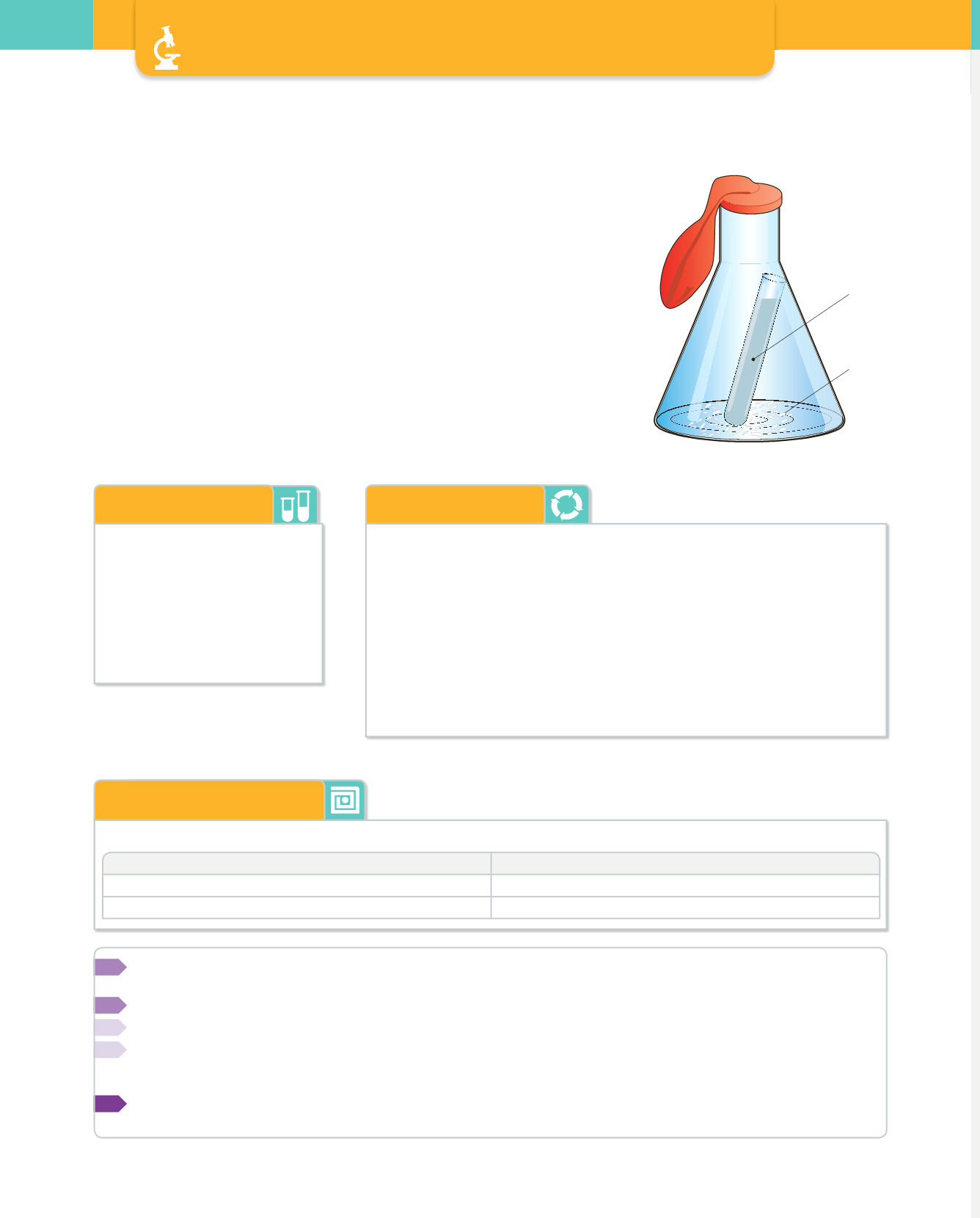
Vierte 50 mL de HCl en el tubo de ensayo e introduce este, con mucho cuida-
do, en el interior del erlenmeyer.
3.
Coloca el globo en la boca del matraz y pesa el conjunto en la balanza. Anota
este valor.
4.
Mueve el erlenmeyer de manera que el HCl contenido en el tubo de ensayo
se vuelque sobre el CaCO
3
y ambos comiencen a reaccionar.
5.
La reacción finaliza cuando ya no observes más desprendimiento de gases.
6.
Vuelve a pesar el conjunto en la balanza y anota el resultado.
Procedimiento
Para analizar los resultados utiliza una tabla como esta:
Análisis de los resultados
Masa inicial del conjunto
Masa final del conjunto
…
…
…
…
Cuando el carbonato de calcio, CaCO
3
, reacciona con el ácido clorhídrico,
HCl, se forma una sustancia sólida, cloruro de calcio, CaCl
2
, y se desprende
una sustancia gaseosa, dióxido de carbono, CO
2
.
La ecuación química ajustada de esta reacción es:
CaCO
3
(s)
+
2 HCl (aq)
→
CaCl
2
(s)
+
H
2
O
+
CO
2
(g)
Para comprobar si la masa se conserva en esta reacción química no pode-
mos llevarla a cabo en un recipiente abierto, porque el CO
2
escaparía a la
atmósfera y no podríamos medir su masa. Tampoco podemos realizarla en
un recipiente herméticamente cerrado, porque el gas que se desprende ele-
varía la presión en el interior del recipiente hasta hacerlo estallar. Conviene,
por tanto, utilizar un recipiente cerrado cuyo volumen pueda aumentar fá-
cilmente cuando se desprenda el CO
2
. Una solución muy sencilla consiste en
acoplar un globo a la boca de un erlenmeyer.
CaCO
3
HCl
¿Permanece la masa del conjunto constante? Si no es así, ¿qué errores experimentales han podido intervenir en la reali-
zación de la práctica? Repite la experiencia evitando los errores experimentales observados.
Como resultado de esta experiencia, enuncia con tus propias palabras la ley de conservación de la masa.
¿Por qué se infla el globo colocado en la boca del erlenmeyer?
Lavoisier quemó fósforo y recogió el gas que se producía; así comprobó que este siempre pesaba más que el fósforo
antes de la combustión, y dedujo que algún gas contenido en el aire había reaccionado con el fósforo. ¿Cómo se llama
el gas contenido en el aire que ha participado en la combustión del fósforo?
Si ponemos 5 g de CaCO
3
en un vaso de vidrio y le agregamos 3,65 g de HCl, obtenemos 5,55 g de una sustancia sólida.
¿Por qué parece que no se cumple la ley de Lavoisier?
1
2
3
4
5


