114
6
7.
IMPORTANCIA DE LAS REACCIONES QUÍMICAS
¿Crees que las reacciones químicas solo tienen lugar en los laboratorios?
En nuestro entorno se producen en cualquier momento centenares de reacciones quí-
micas. Muchas suceden en la naturaleza sin la intervención del ser humano: la fotosín-
tesis, la corrosión de los metales, la respiración de los seres vivos, la descomposición de
los alimentos, el reciclado natural de las sustancias…
Los científicos han estudiado el comportamiento de las reacciones y han fabricado
en los laboratorios nuevas sustancias,
sustancias sintéticas,
que no existían en la
naturaleza, y que son semejantes a las naturales.
Por otro lado, muchas
sustancias naturales,
como los metales, no suelen encontrarse
libres en la naturaleza, sino en forma de óxidos, sulfuros y carbonatos. Solo mediante
reacciones químicas conseguimos obtener metales como el hierro, el aluminio, el cobre…
En los últimos doscientos años, el estudio de las reacciones químicas ha contribuido a
mejorar nuestra calidad de vida y, en consecuencia, la esperanza de vida ha aumentado
significativamente. La fabricación de los medicamentos, los fertilizantes, los desinfec-
tantes, etc., son ejemplos de procesos químicos que han beneficiado a la humanidad.
Pero no todo son beneficios: muchos de estos procesos de fabricación de nuevas sustan-
cias, su transporte, o el desplazamiento de los seres humanos, conllevan reacciones de
combustión de combustibles fósiles que han aumentado considerablemente las emisiones
de dióxido de carbono y provocado problemas medioambientales a nivel global. Asimis-
mo, el uso de sustancias sintéticas, como los CFC, o los vertidos incontrolados de dese-
chos no reciclables, también han deteriorado gravemente la naturaleza. Si bien es posible
encontrar solución a muchos de estos problemas recurriendo a nuevos procedimientos
químicos, siempre será necesaria la voluntad de los seres humanos para poder resolverlos.
7.1.
Reacciones de oxidación-reducción
¿Qué reacciones químicas crees tú que permiten obtener los metales libres?
Una
reacción de reducción
es cualquier proceso en el que un compuesto
pierde
oxígeno.
Para reducir el óxido de hierro, le hacemos reaccionar con carbono o con monóxido
de carbono:
FeO (s)
+
C (s)
→
CO (g)
+
Fe (s)
FeO (s)
+
CO (g)
→
CO
2
(g)
+
Fe (s)
En estas reacciones, el óxido de hierro se ha reducido porque ha perdido oxígeno; sin
embargo, el carbono o el monóxido de carbono se han oxidado porque han ganado oxí-
geno. En los altos hornos, estas reacciones permiten obtener hierro a partir de sus óxidos.
¿Existe la reacción contraria a la reducción?
Una
reacción de oxidación
es cualquier proceso en el que un elemento o un
compuesto
gana oxígeno.
Hemos visto que la oxidación del hierro es una reacción que tiene lugar en la natura-
leza cuando lo dejamos a la intemperie durante un tiempo. Veamos cómo se produce
químicamente.
Muchos metales se oxidan en contacto con el oxígeno para dar óxidos metálicos. Así,
el hierro puede dar lugar a dos formas oxidadas: el monóxido de hierro y el trióxido de
dihierro:
2 Fe (s)
+
O
2
(g)
→
2 FeO (s)
4 Fe (s)
+
3 O
2
(g)
→
2 Fe
2
O
3
(s)
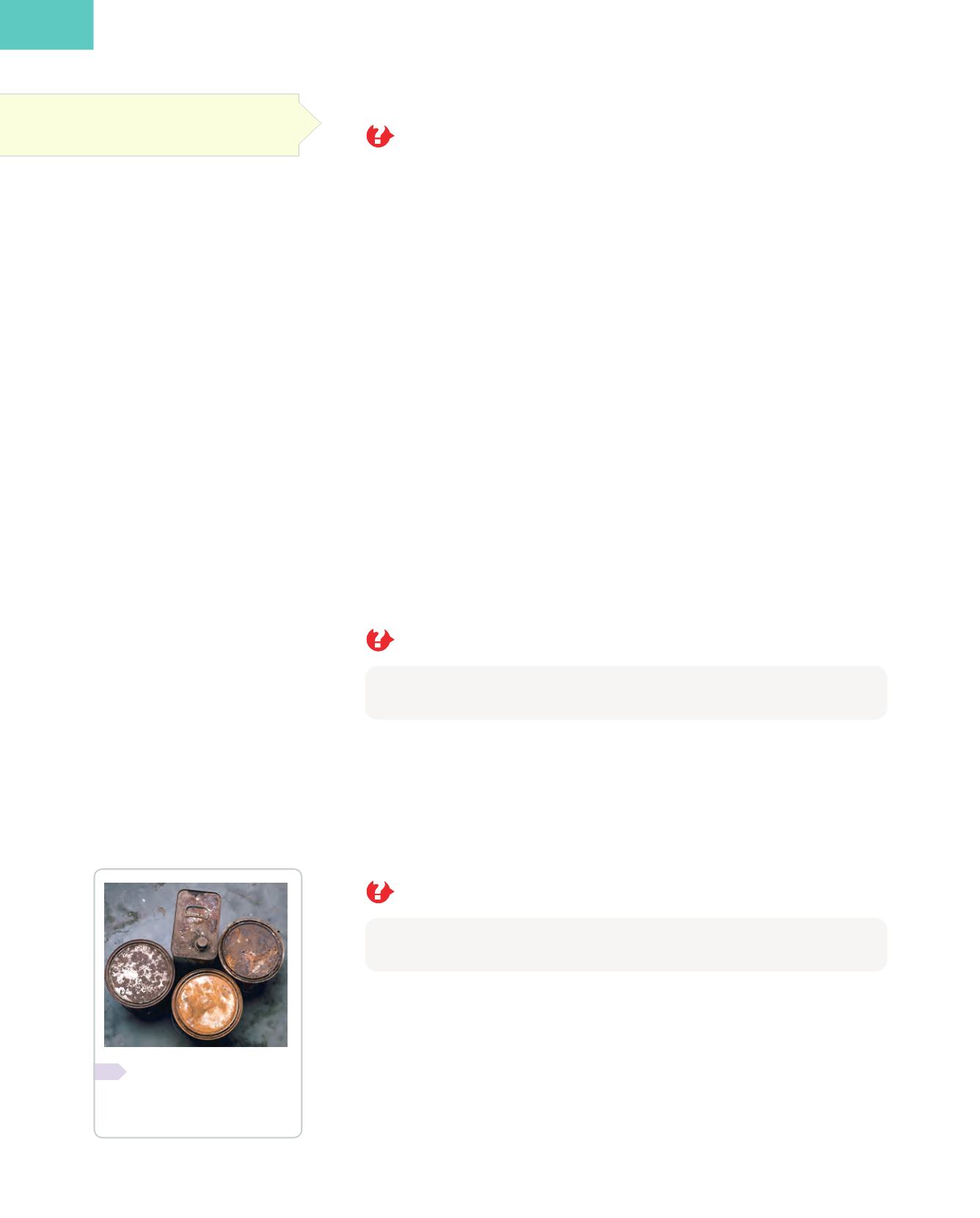
❚❚
Las sustancias se forman
debido a distintos procesos
químicos.
Busca a tu alrededor ob-
jetos que se hayan oxidado y
explica en cada caso por qué
ha ocurrido.
27


