119
6. Las reacciones químicas
+
www
8.2.
Disminución del ozono estratosférico
La
capa de ozono
es una zona muy delgada de la estratosfera situada a unos 25 km
por encima de la superficie terrestre. Contiene el 90% del ozono atmosférico (O
3
). Esta
sustancia actúa como un filtro que absorbe los rayos ultravioletas procedentes del sol,
muy perjudiciales para los seres vivos.
Hablamos de
disminución del ozono estratosférico
o de
agujero en la capa de
ozono
cuando la concentración de ozono en esa zona es inferior a lo que se considera
normal. Este fenómeno se observa durante la primavera en las regiones polares ártica
y antártica.
Según
Mario Molina,
premio nobel de química en 1995, la causa de la destrucción del
ozono estratosférico es antropogénica. Para este científico, los CFC contenidos en los
aerosoles y en otros productos escapan a la atmósfera y alcanzan la estratosfera. Una
vez allí, la acción de la radiación ultravioleta procedente del sol hace que estos gases
se disocien para dar dos átomos de cloro, muy reactivos, que provocan la destrucción
del ozono estratosférico.
Consecuencias
Prevención
❚
❚
Incremento del número de casos de cáncer
de piel.
❚
❚
Destrucción de cultivos y vegetación.
❚
❚
Disminución de la vida en los océanos.
❚
❚
Eliminar el uso de los CFC.
❚
❚
Utilizar un factor de protección
solar elevado para evitar el cáncer
de piel.
8.3.
La lluvia ácida
Se denomina
lluvia ácida
a las precipitaciones en forma de lluvia, nieve o niebla que
tienen un pH inferior a 5,6.
Se produce cuando la humedad del aire se combina con los óxidos de nitrógeno y azu-
fre gaseosos emitidos a la atmósfera por las centrales térmicas, los vehículos, las fábri-
cas y las calefacciones, que queman combustibles fósiles y originan sustancias ácidas.
8.3.1.
Reacciones químicas responsables de la lluvia ácida
Las siguientes reacciones químicas tienen lugar en la atmósfera y generan sustancias
ácidas que resultan muy dañinas para el medio ambiente:
SO
2
+
H
2
O
→
H
2
SO
3
SO
3
+
H
2
O
→
H
2
SO
4
N
2
O
3
+
H
2
O
→
2 HNO
2
N
2
O
5
+
H
2
O
→
2 HNO
3
Consecuencias
Prevención
❚
❚
La acidez de la lluvia destruye bosques y cosechas.
❚
❚
Aumenta la acidez del agua de los ríos y lagos, lo
que perjudica la vida acuática.
❚
❚
Destruye la piedra caliza de los monumentos
históricos.
❚
❚
Reducir las emisiones a la
atmósfera de óxidos de
nitrógeno y azufre.
❚
❚
Evitar la combustión de
combustibles fósiles.
Identifica los reactivos y los productos de las reacciones cuyas ecuaciones
químicas aparecen en este apartado.
Identifica los agentes causantes del incremento del efecto invernadero, la
disminución del ozono estratosférico y la lluvia ácida.
Explica en qué consiste el efecto invernadero y en qué medida se ve afec-
tado por la presencia en la atmósfera de ciertos gases, como el metano, los
óxidos de nitrógeno y los CFC.
❚❚
¿Qué otro problema medioambiental origina la presencia de los CFC en
la estratosfera?
1742
174443
1744
Ideas claras
❚❚
El aumento de las reacciones
de combustión de combus-
tibles fósiles, ha elevado las
emisiones de CO
2
a la atmós-
fera e incrementado el efecto
invernadero, causando el so-
brecalentamiento del planeta.
❚❚
La disminución de la capa de
ozono es debida a la presen-
cia de gases CFC.
❚❚
La lluvia ácida son precipita-
ciones que tienen un pH infe-
rior a 5,6.
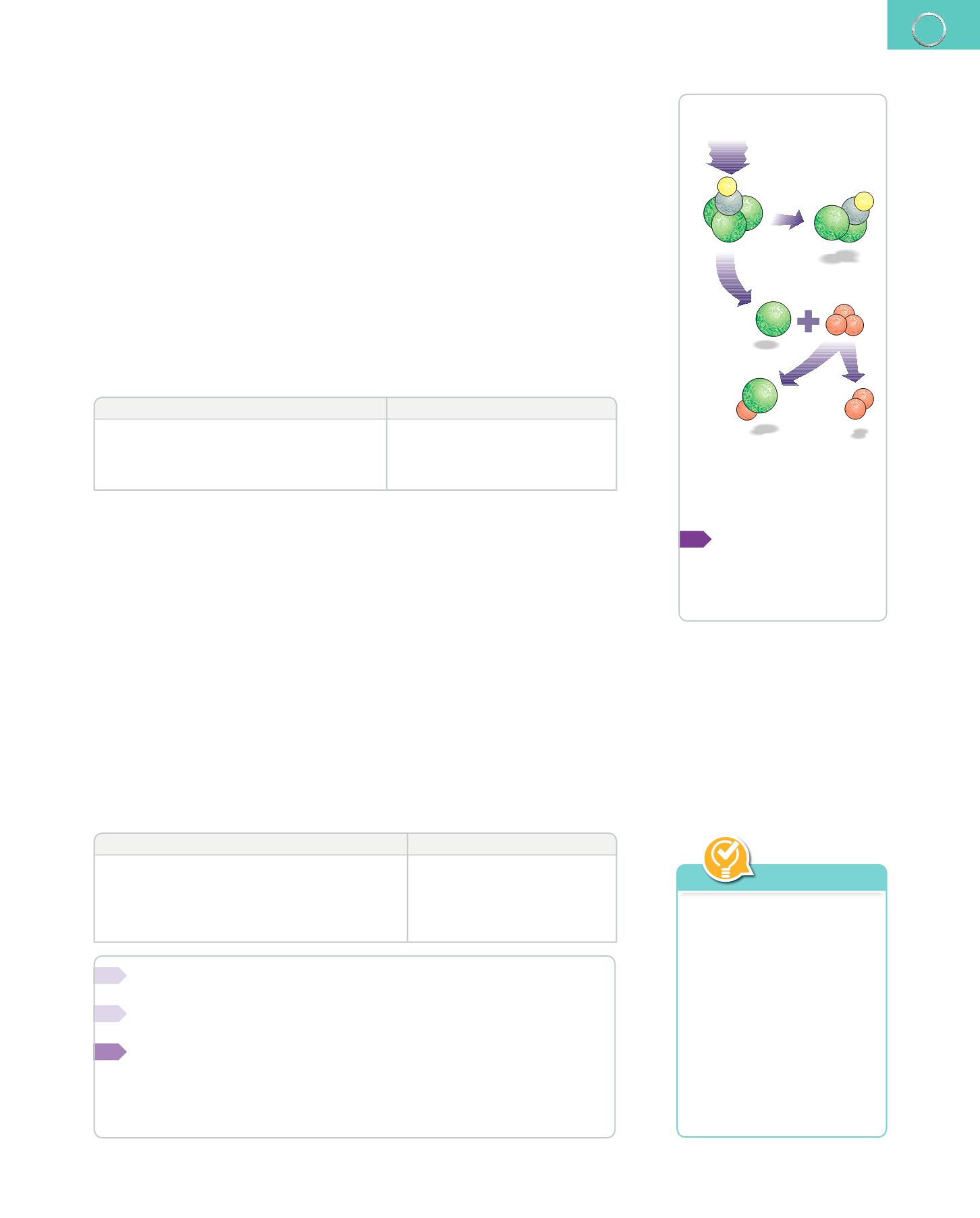
radiación
ultravioleta
CFC con dos
átomos
de cloro
CFC con tres
átomos
de cloro
flúor
carbono
cloro
átomo
de cloro
monóxido
de cloro
se libera
oxígeno
O
3
O
2
Mecanismo de acción de los
gases CFC sobre el ozono. Se
calcula que por cada átomo de
cloro se destruyen unas 100000
moléculas de ozono.
Busca información e imá-
genes sobre la reducción de la
capa de ozono en los últimos
años. Compara estas imágenes
en las dos últimas décadas.
41


