67
3. El átomo
+
www
3.2.
El modelo atómico de Rutherford
El modelo atómico de Thomson fue aceptado durante algunos años, hasta que se com-
probó que no podía explicar los resultados de experimentos realizados posteriormente.
3.2.1.
Experimento de Rutherford, Geiger y Marsden
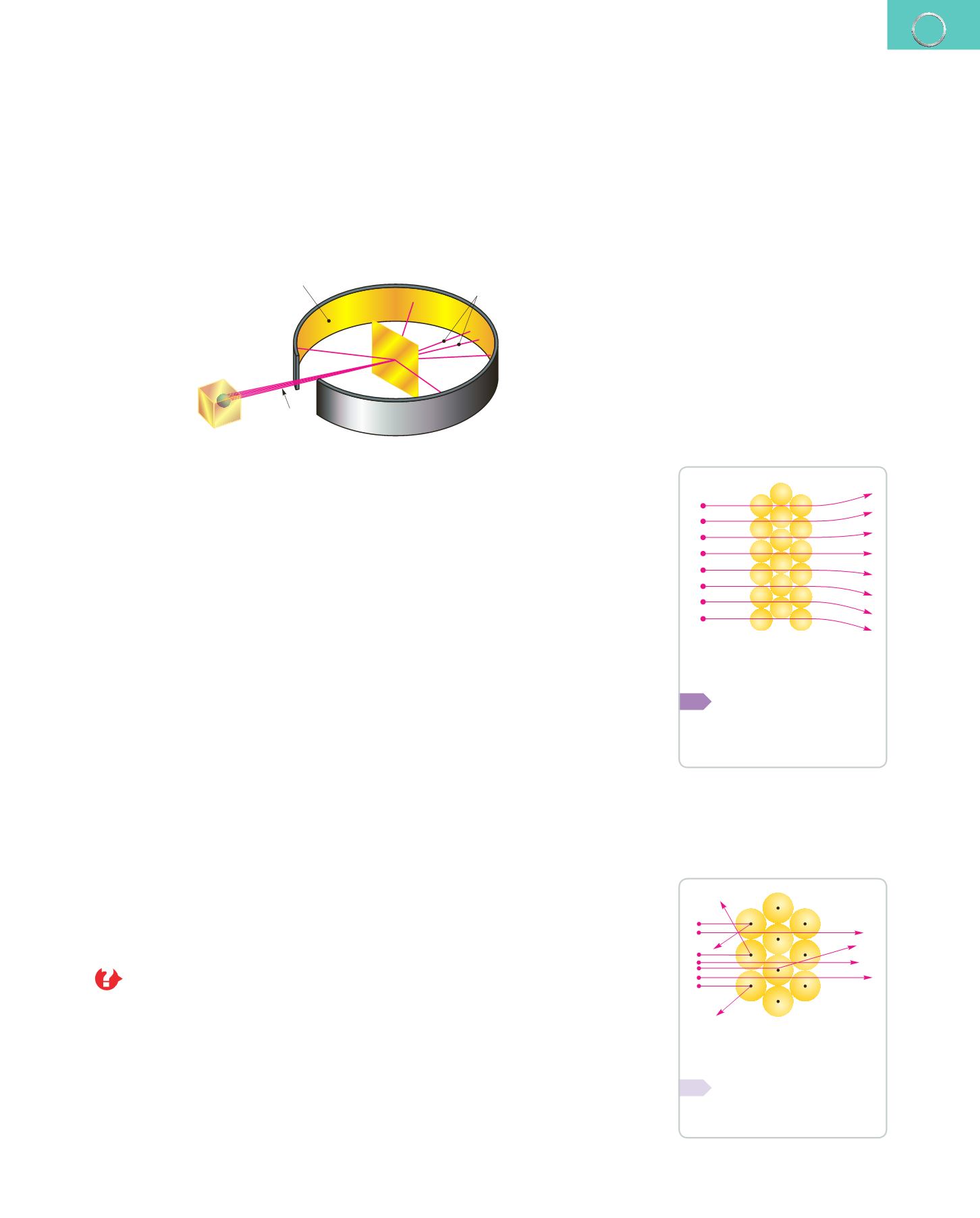
En 1909,
E. Rutherford
(1871-1937) y sus colaboradores,
H. Geiger
(1882-1945) y
E. Marsden
(1889-1970), bombardearon una lámina de oro muy fina con partículas
cargadas positivamente y a gran velocidad.
+
+
+
+
+
+
+
+
Partículas
Átomos
Según el modelo de Thomson,
esto es lo que debería haber
ocurrido.
¿Cómo deberían com
portarse las partículas positi
vas al incidir con el átomo se
gún el modelo de Thomson?
15
1
3
2
+
+
++
+
+
+
Trayectorias que siguen las
partículas positivas al atravesar
la lámina de oro.
¿Qué les ha sucedido a
las partículas que describen
las trayectorias 1, 2 y 3?
16
Como se observa en el dibujo, y de acuerdo con el modelo atómico de Thomson, lo
que tendría que haber ocurrido es que las partículas positivas hubieran atravesado la
lámina sin ser apreciablemente desviadas de su trayectoria rectilínea.
Sin embargo, este fue el resultado del experimento:
❚❚
La mayor parte de las partículas
atravesaron
la finísima lámina de oro sin cambiar la
dirección, como era de esperar.
❚❚
Algunas se
desviaron
considerablemente.
❚❚
Sorprendentemente, algunas partículas
rebotaron
hacia la fuente de emisión.
Tras estos inesperados resultados, Rutherford llegó a las siguientes conclusiones:
❚❚
El hecho de que las partículas positivas que se dirigen a gran velocidad hacia la lá-
mina de oro la atraviesen sin desviarse indica que el
átomo
es, en su mayor parte,
espacio vacío.
❚❚
El hecho de que algunas partículas positivas procedentes de la fuente se desvíen in-
dica que han pasado cerca de una zona del átomo que también tiene carga positiva
y las ha repelido.
❚❚
El hecho de que algunas partículas positivas reboten hacia la fuente emisora indica que
existen choques directos contra una zona del átomo muy densa y fuertemente positiva,
que denominó
núcleo atómico.
Después de analizar los resultados, Rutherford describió un modelo de
átomo nuclear
que consta de dos zonas diferenciadas:
❚❚
Una
zona central
del átomo muy pequeña, muy densa y cargada positivamente,
pues es donde se encuentran los protones.
❚❚
Una
zona periférica
en la que los electrones, cargados negativamente, giran alrede-
dor del núcleo y a cierta distancia del él.
Entonces, ¿cómo justifica el modelo de Rutherford la experiencia de la lámina
de oro?
❚❚
Explicación de Rutherford al experimento de la lámina de oro
1.
La carga positiva está concentrada en el núcleo central, de manera que las partículas
positivas que pasan muy cerca de él se desvían mucho de su trayectoria rectilínea.
2.
Las partículas positivas que colisionan directamente contra el núcleo, muy denso y
positivo, rebotan en la dirección de la que proceden.
3.
Las partículas que pasan lejos del núcleo no se desvían de su trayectoria.
Fuente de
partículas
positivas
Partículas
cargadas
positivamente
Atraviesan sin
cambiar de
dirección
Se desvían
Rebotan
Detector de
partículas


