+
www
75
3. El átomo
21
¿Por qué se vio obligado Rutherford a suponer que
en el núcleo debía existir una partícula que aún no se
había descubierto y a la que denominaron neutrón?
¿Qué partículas son, fundamentalmente, las responsa
bles de la masa del átomo?
22
Escribe en tu cuaderno la opción correcta. La carga del
electrón es:
a)
Mayor que la del protón.
b)
Menor que la del neutrón.
c)
Igual que la del protón.
23
Las partículas con las que Geiger y Marsden bombar
dearon la fina lámina de oro eran partículas alfa.
Una partícula alfa es un átomo de helio que tiene en
su núcleo dos protones y dos neutrones, pero ha per
dido sus dos electrones:
a)
¿Cuál es la carga de una partícula alfa?
b)
¿Cuál será la masa en kilogramos de una partícula alfa?
c)
Dibuja un átomo completo de helio y una partícula alfa a
partir de un átomo de helio.
24
En esta página web puedes encontrar un simulador
del experimento de Geiger y Marsden. Describe lo que
sucede cuando se modifican la energía de las partícu
las incidentes y el material del que está hecho el blan
co contra el que se disparan.
Con la ayuda de las simulaciones, explica qué se esperaba
que sucediera de acuerdo con el modelo de Thomson y qué
es lo que realmente sucedió.
mo/rutherford.htm
25
Relaciona cada partícula: electrón, protón y neutrón,
con alguna o algunas de las características siguientes:
a)
Tiene carga eléctrica positiva.
b)
No posee carga eléctrica.
c)
Se encuentra solo en el interior del núcleo.
d)
Gira alrededor del núcleo.
e)
Tiene una masa ligeramente mayor que la del protón.
f)
Tiene carga eléctrica negativa.
g)
Su masa es menor que la del protón.
26
Un átomo de hidrógeno está formado por un protón y
un electrón.
a)
¿Cuál es la masa del átomo de hidrógeno?
b)
¿Qué le ocurrirá al átomo de hidrógeno si pierde su úni-
co electrón?
27
Escribe en tu cuaderno las opciones correctas y corrige
las incorrectas.
a)
Un átomo de flúor se convierte en un anión cuando pier-
de un protón.
b)
Un átomo de flúor se convierte en un anión cuando gana
un electrón.
c)
Un átomo de sodio se convierte en un catión ganando
un protón.
d)
Un átomo de sodio se convierte en un catión perdiendo
un electrón.
Los primeros modelos atómicos
13
Describe cómo es el modelo de átomo ideado por
Thomson. Según este modelo, ¿cómo es el átomo, di
visible o indivisible?
14
¿Cómo explica el modelo atómico de Thomson los fe
nómenos de electrización por frotamiento? Explícalo
con la ayuda de esquemas o dibujos.
15
¿Cómo adquiere un cuerpo eléctricamente neutro car
ga positiva? ¿Y carga negativa?
16
¿Qué relación hay entre el número de electrones y el
de protones en la materia eléctricamente neutra?
17
Copia en tu cuaderno y completa los textos siguientes:
«Durante mucho tiempo, los científicos creyeron que los
átomos eran las partículas más pequeñas de la materia.
Actualmente sabemos que los átomos están formados por
partículas más pequeñas llamadas _, _ y _.»
«Un _ es una partícula que tiene carga positiva y está lo-
calizada en el _ del átomo. El _ es una partícula que no
tiene carga eléctrica y que, junto al _, está localizada en el
_ del átomo. Existe una tercera partícula, llamada _, que
tiene carga eléctrica _ y que no está localizada en el _ del
átomo.»
18
Relaciona a los siguientes científicos: Geiger y Mars
den, J. J. Thomson, E. Goldstein, J. Chadwick y R.
Rutherford, con su aportación al estudio de la estruc
tura del átomo:
a)
Descubrimiento del protón.
b)
Descubrimiento del electrón.
c)
Modelo atómico del pudin de pasas.
d)
Descubrimiento del neutrón.
e)
Experiencia de la lámina de oro.
f)
Modelo del átomo nuclear.
19
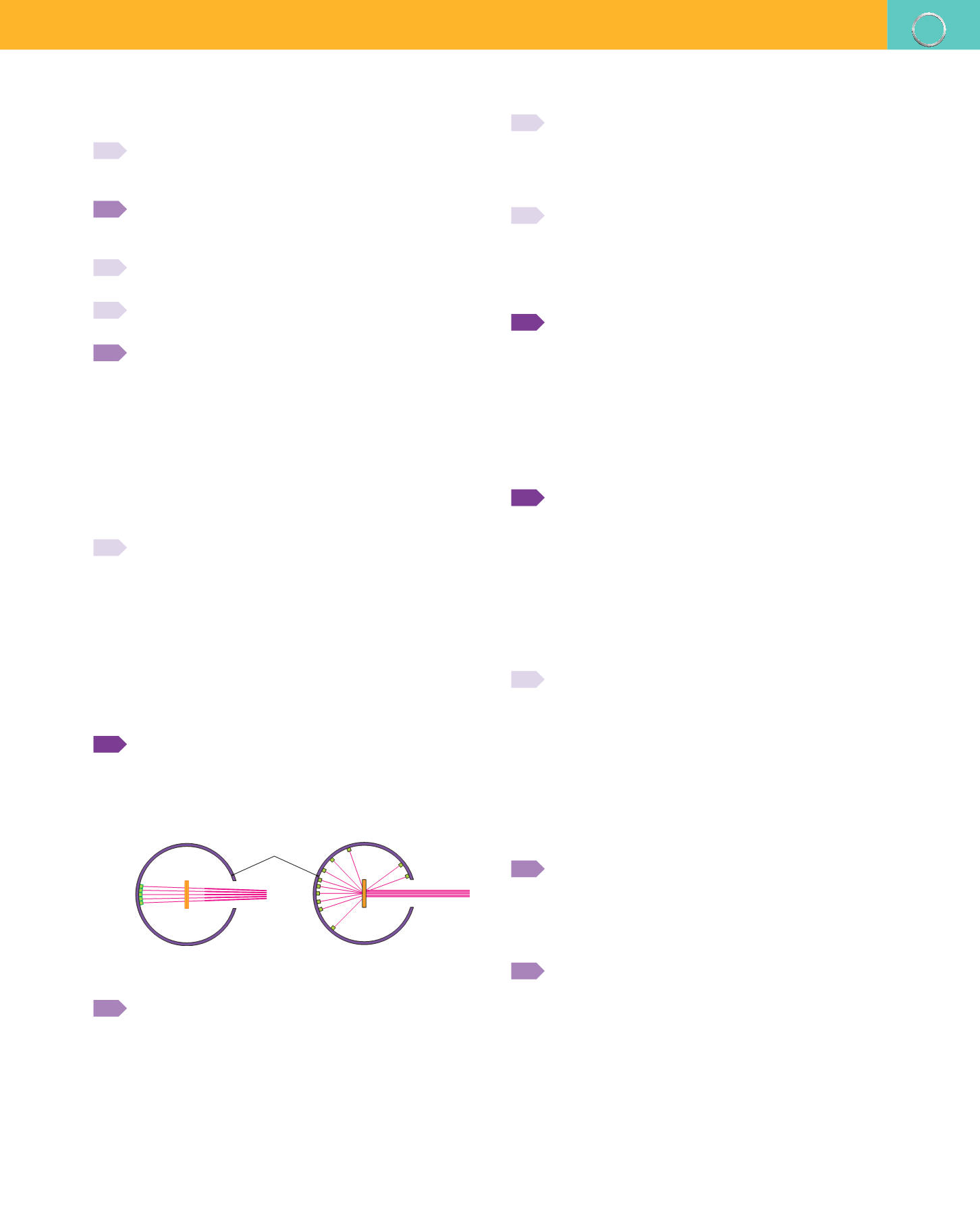
En las ilustraciones se representan las experiencias de
Geiger y Marsden. En una de ellas observamos cuáles
eran los resultados esperados de acuerdo con el mo
delo de Thomson y en la otra, los resultados reales.
Identifica cada una de estas ilustraciones y explica:
Lámina
de oro
Chorro de
partículas
Pantalla detectora
de partículas
Chorro de
partículas
a)
Por qué eran esperables estos resultados, según Thomson.
b)
Cómo justifica Rutherford esos resultados experimentales.
20
Explica cómo justifica el modelo atómico de Ruther
ford que en el experimento de Geiger y Marsden:
a)
La mayor parte de las partículas positivas atravesaran la
lámina de oro sin desviarse.
b)
Algunas partículas positivas se desviaran considerable-
mente.
c)
Unas pocas partículas positivas rebotaran hacia la fuente
de emisión.


