76
¿Cómo se identifican los átomos?
28
Copia en tu cuaderno y completa la siguiente frase:
«El número atómico del cobre, Cu, es 29, y su número má-
sico 64, lo cual quiere decir que este átomo de cobre tiene _
protones y _ neutrones, y si es eléctricamente neutro, tiene
_ electrones.»
29
Representa los átomos de cada uno de los elementos
siguientes:
❚❚
Oxígeno, símbolo O,
Z
=
8,
A
=
16.
❚❚
Nitrógeno, símbolo N,
Z
=
7,
A
=
14.
❚❚
Calcio, símbolo Ca,
Z
=
20,
A
=
40.
❚❚
Magnesio, símbolo Mg, número de protones 12 y número
de neutrones 13.
❚❚
Bromo, símbolo Br, número de protones 35 y número de
neutrones 45.
30
Determina el número de protones, neutrones y elec
trones de:
a)
Un átomo de
65
30
Zn eléctricamente neutro.
b)
Un ion
85
37
Rb
+
.
c)
Un ion
80
35
Br
−
.
d)
Un átomo de
81
35
Br eléctricamente neutro.
e)
Un átomo de
205
82
Pb eléctricamente neutro.
31
El número de neutrones del litio es uno más que el de
protones. Sabiendo que su número másico es 7:
a)
¿Cuál es su número atómico?
b)
¿Cuántos electrones tiene un átomo de litio eléctrica-
mente neutro?
32
¿Puede un átomo de número atómico 17 tener como
isótopo otro átomo cuyo número atómico sea 18? Jus
tifica tu respuesta.
33
Conocemos los siguientes datos sobre los átomos A, B,
C y D:
A
B
C
D
13 protones
14 neutrones
13 protones
13 neutrones
14 protones
15 neutrones
14 protones
15 neutrones
a)
¿Cuáles pertenecen a isótopos diferentes del mismo ele-
mento?
b)
¿Cuáles pertenecen al mismo isótopo del mismo ele-
mento?
c)
¿Son B y C átomos del mismo elemento?
34
El número de neutrones del sodio es dos más que el de
protones. Si su número másico es 23, ¿cuántos electro
nes tendrá?
35
Escribe el número de protones, neutrones y electrones
de cada uno de estos átomos:
a)
13
6
C
b)
26
56
Fe
c)
39
14
K
+
d)
16
8
O
2
−
Los nuevos modelos atómicos
36
Elige y copia en tu cuaderno la opción correcta.
a)
Cuando un átomo es excitado, algunos electrones pue-
den pasar de niveles de _ energía a otros de _ energía.
b)
Cuando un electrón emite energía es porque ha pasado
de un nivel de _ energía a otro de _ energía.
37
Corrige las afirmaciones que sean falsas.
a)
El nivel energético 2 puede contener como máximo
18 electrones.
b)
El nivel energético 1 puede contener como máximo
2 electrones.
c)
El modelo atómico de Rutherford no es válido, porque
cualquier carga eléctrica que gire debe emitir radiación y
esto no sucede.
d)
El primer postulado de Bohr afirma que el electrón se
mueve alrededor del núcleo en órbitas circulares, sin que
exista emisión de energía.
e)
Según Bohr, todos los electrones de un átomo se en-
cuentran en un mismo nivel de energía.
38
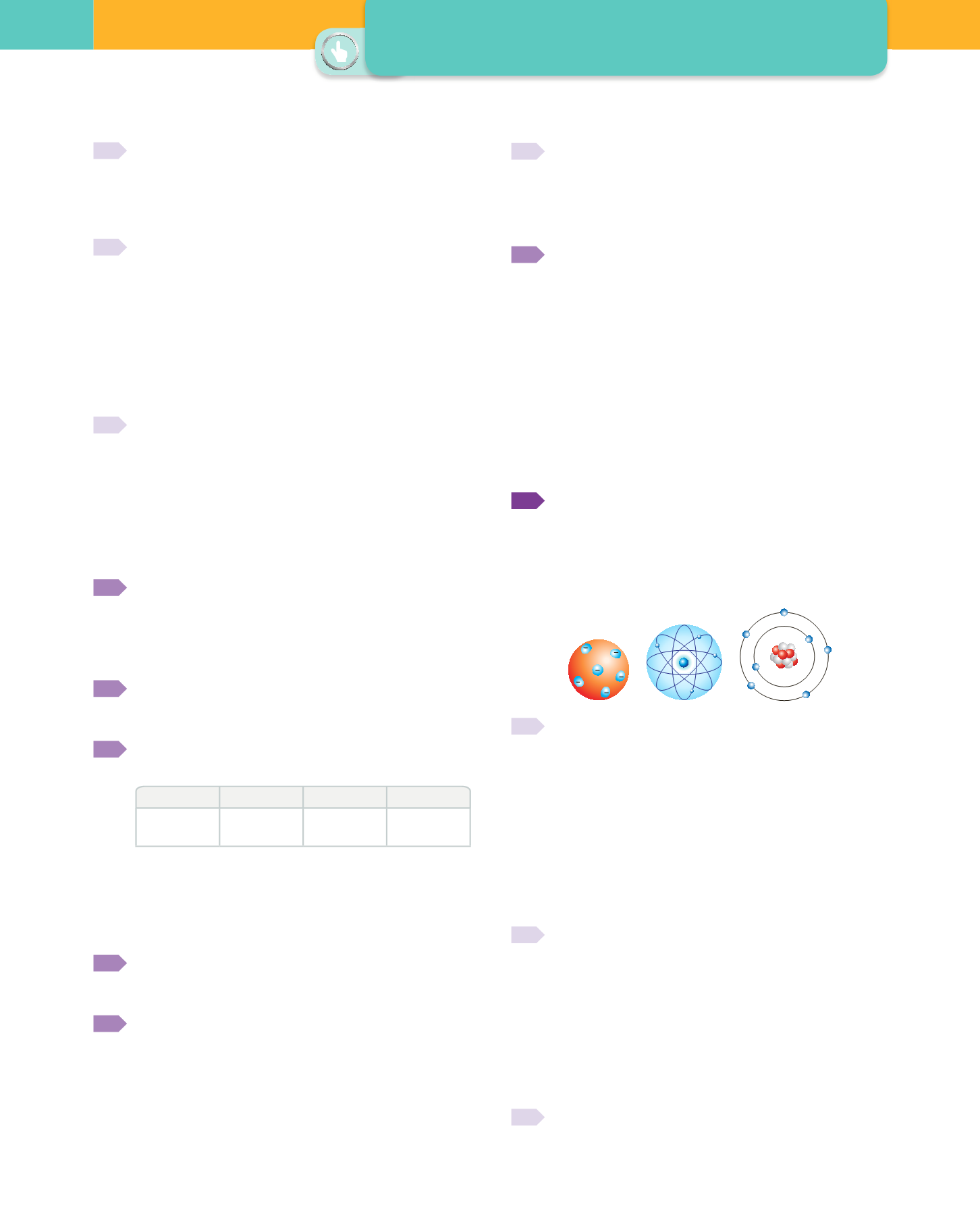
Responde a las siguientes cuestiones relacionadas con
los modelos atómicos de Bohr, Thomson y Rutherford.
a)
Ordena cronológicamente estos modelos atómicos.
b)
Describe brevemente las características de cada uno de
los modelos.
c)
Asocia cada modelo con uno de los siguientes dibujos:
+
+
+
+
J.J. Thomson (1904)
(modelo pastel de pasas)
E. Rutherford (1909)
(modelo nuclear)
N. Bohr (1013)
(modelo niveles de energía)
39
Asocia cada término con su definición: número atómi
co, isótopo, núcleo atómico, ion y neutrón.
a)
El centro de un átomo.
b)
Número de protones en un núcleo.
c)
Partícula nuclear sin carga eléctrica.
d)
Átomo con carga eléctrica.
e)
Átomos de un mismo elemento con diferente número de
neutrones en su núcleo.
Cómo dibujar átomos
40
Relaciona los siguientes átomos: helio (2 electrones),
flúor (9 electrones), litio (3 electrones), sodio (11 elec
trones) y argón (18 electrones) con la configuración
electrónica correspondiente:
a)
2 8 8
b)
2
c)
2 7
d)
2 1
e)
2 8 1
41
Dibuja el núcleo y los niveles de energía de un átomo
de fósforo,
Z
=
15,
A
=
31.
EJERCICIOS, ACTIVIDADES Y TAREAS
3


