70
3
5.
LOS NUEVOS MODELOS ATÓMICOS
Según el modelo del átomo nuclear o planetario,
los electrones giran a gran velocidad en torno al
núcleo sin que sepamos a qué distancia de él se
encuentran. Sin embargo, es un hecho conocido
que cualquier carga eléctrica que gire debe emitir
energía en forma de radiación. Si esto sucediera,
el electrón iría perdiendo energía y se acercaría
cada vez más al núcleo describiendo una
trayec-
toria espiral,
y acabaría cayendo sobre él.
5.1.
El modelo de los niveles de energía de Bohr
En 1913,
Niels Bohr
(1885-1962) modificó el modelo atómico de Rutherford mediante
los siguientes postulados:
1.
El electrón solo se mueve en unas órbitas circulares,
sin que exista emisión de
energía.
El electrón, dependiendo de la órbita en la que se encuentre, tiene una de-
terminada energía, que es tanto mayor cuanto más alejada está la órbita del núcleo.
2.
La emisión de energía solo se produce cuando un electrón salta de un nivel energé-
tico (órbita) de mayor energía a otro de menor energía.
Entonces, ¿cómo se distribuyen los electrones en estos niveles?
5.2.
La distribución de los electrones
A partir de 1916 se desarrollaron otros modelos atómicos para tratar de explicar las
propiedades químicas de los elementos. Así, los científicos llegaron a la conclusión de
que los electrones están distribuidos en
niveles
y
subniveles
de energía que admiten
un número máximo de electrones.
Nivel 1 (K)
Número máximo de electrones: 2
Nivel 2 (L)
Número máximo de electrones: 8
Subnivel 1
2 electrones
Subnivel 2
6 electrones
Nivel 3 (M)
Número máximo de electrones: 18
Subnivel 1
2 electrones
Subnivel 2
6 electrones
Subnivel 3
10 electrones
Nivel 4 (N)
Número máximo de electrones: 32
Subnivel 1
2 electrones
Subnivel 2
6 electrones
Subnivel 3
10 electrones
Subnivel 4
14 electrones
La distribución por niveles de los electrones de un átomo de un elemento recibe el
nombre de
configuración electrónica
del elemento.
Los electrones situados en el último nivel energético de un átomo se denominan
elec-
trones de valencia,
y son los responsables de las propiedades químicas de las sustan-
cias, como veremos en la próxima unidad.
❚❚
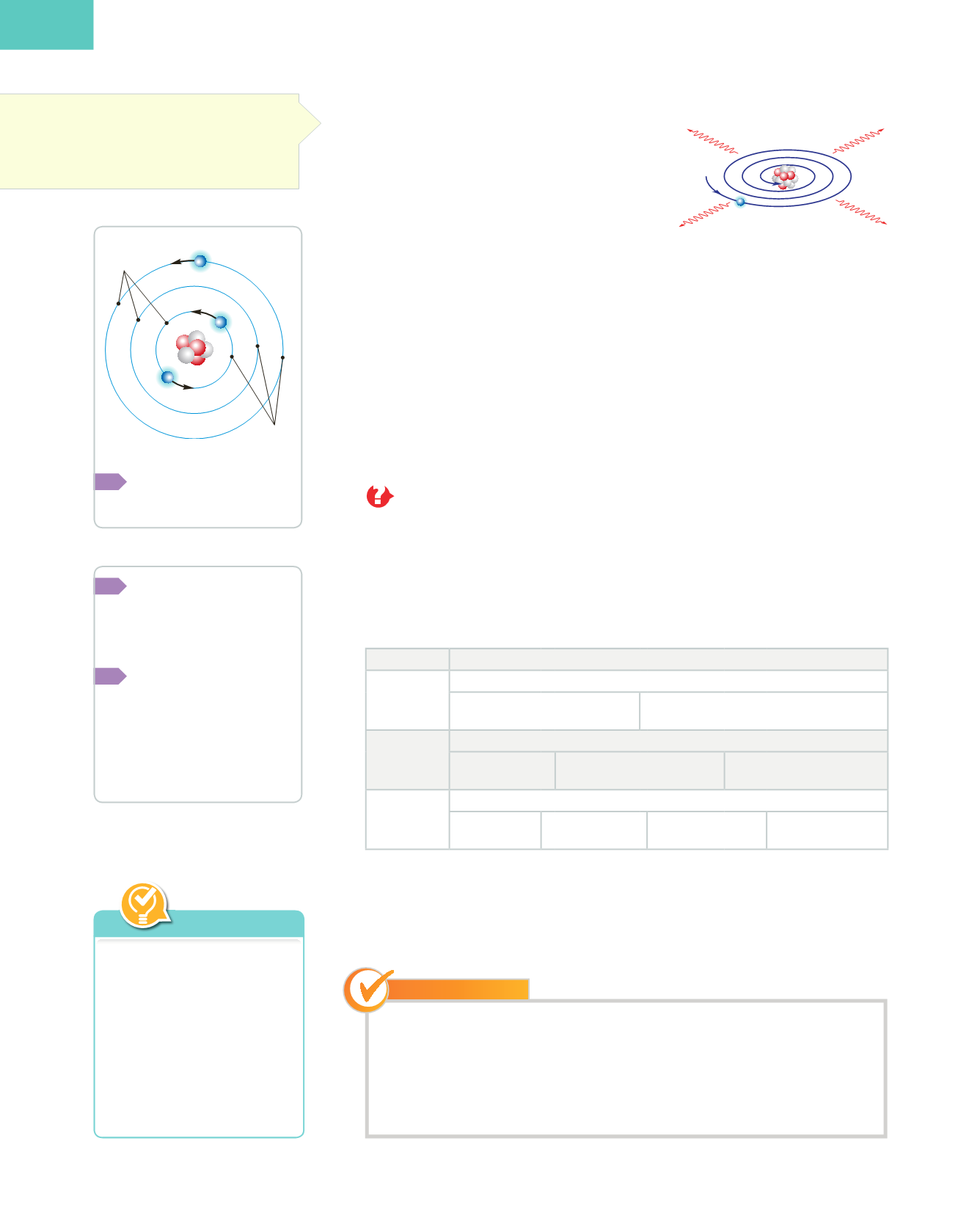
El átomo, según Rutherford,
está formado por un núcleo
con carga positiva alrededor
del cual giran los electrones,
con carga negativa.
niveles
núcleo
electrón
órbitas
estables
1
2
3
–
–
–
Modelo atómico de Bohr.
¿
Qué sucede si el elec
trón del nivel 3 pasa al ni
vel 2?
25
El átomo de berilio tiene
4 electrones. Indica cuáles de
estas configuraciones electró
nicas es la correcta:
a)
2 2
b)
2 1 1
c)
1 1 1 1
El átomo de potasio tiene
19 electrones. Indica cuál de
estas configuraciones electró
nicas es la correcta:
a)
2 2 6 2 6 1
b)
2 2 5 2 5 3
c)
2 8 8 1
26
27
3.
Escribe la configuración electrónica del Mg y del Mg
2+
.
❚
❚
El Mg tiene 12 electrones que hay que distribuir en los diferentes
niveles y subniveles.
❚
❚
La configuración electrónica del Mg es: 2 2 6 2
=
2 8
2
❚
❚
El Mg
2+
tiene dos electrones menos. Su configuración es: 2 2 6
=
2 8
EJERCICIO RESUELTO
Ideas claras
❚❚
Los
electrones
se distribuyen
alrededor del núcleo en
nive-
les
y
subniveles
de energía.
❚❚
Cada nivel y subnivel admite
un
número máximo
de elec-
trones.
❚❚
La
configuración electrónica
es una forma de representar la
distribución de los electrones
de un átomo.
Energía emitida por el electrón.


