107
7
Niveles de organización de los seres vivos
la especie y para el individuo, ya que aumenta las probabi-
lidades de que aparezcan características ventajosas en los
individuos, así elimina o disminuye la probabilidad de que
existan genes no deseados, como los que son portadores de
enfermedades.
8
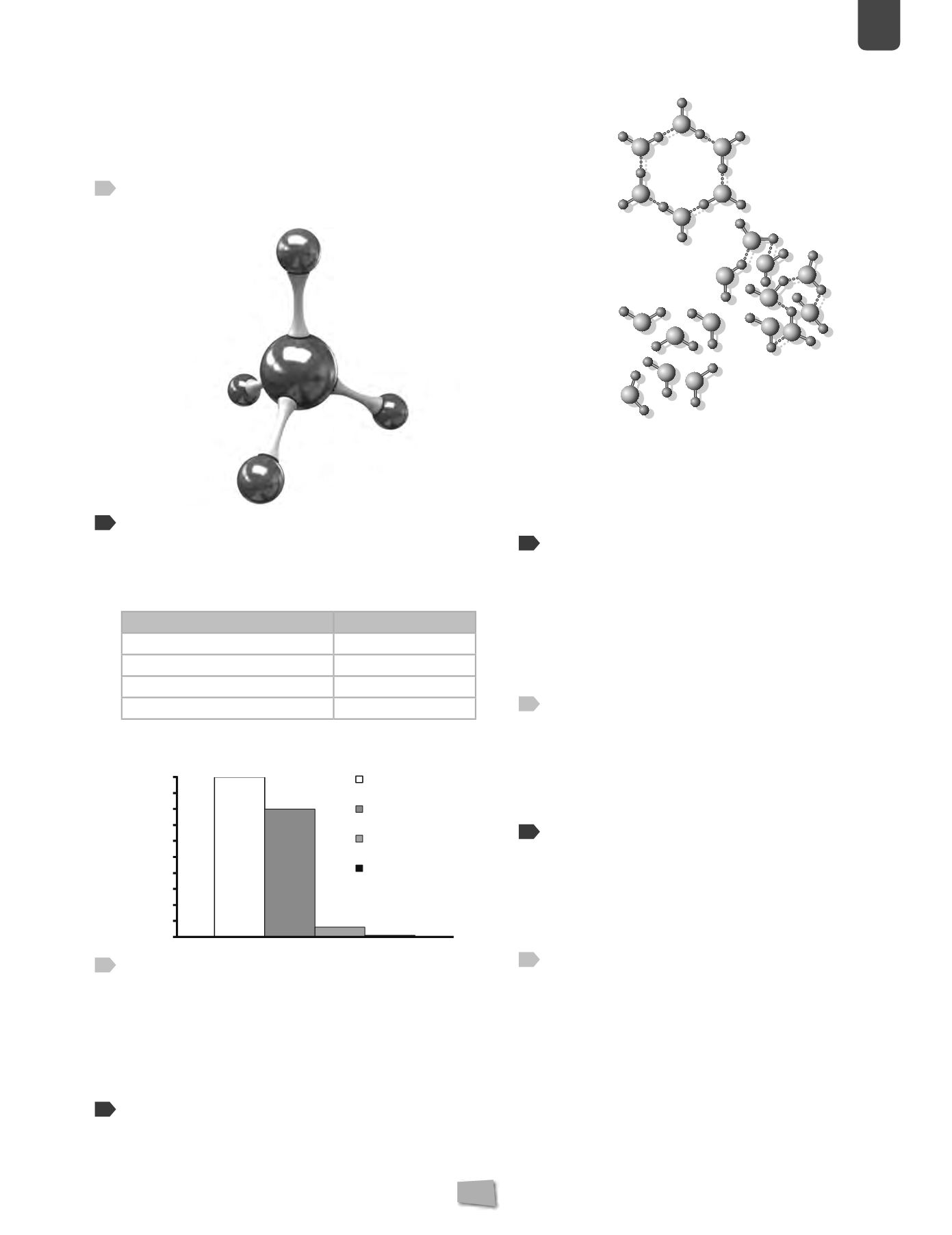
Observa el modelo molecular del metano, recuerda la
fórmula del propano y realiza su modelo molecular.
Propano C
3
H
8
9
La energía requerida para formar un enlace químico es
la misma que se necesita para romperlo. Observa la si-
guiente tabla, donde se indican la energía de cada tipo
de enlace químico. Haz un diagrama de barras y escribe
las conclusiones sobre la fortaleza de cada tipo de enlace.
Tipo de enlace
Energía Kcal/mol
Covalente
50 a 100
Iónico
1 a 80
Puente de hidrógeno
3 a 6
Fuerzas de Van der Waals
0,5 a 1
0
10
20
30
40
50
60
70
80
90
100
Enlace covalente
Enlace iónico
Puente de
hidrógeno
Fuerzas de
Van der Waals
Energía(kcal/mol)
10
Busca y cita dos ejemplos en los que el agua participe
en la regulación térmica de un organismo vivo.
El agua sirve para regular la temperatura corporal, ya que
constituye la mayor parte del líquido corporal e interviene
en los mecanismos de regulación térmica en animales ho-
meotermos. Además, ayuda a enfriar el cuerpo cuando se
evapora al encontrarse en forma de película de sudor sobre
la piel.
11
Investiga cuál es la temperatura a la que el agua ad-
quiere la máxima densidad. Observa la figura 7.8 y ex-
plica cuál es la razón.
O
H
Sólido
Líquido
Gaseoso
O
O
O
O
O
O
O
O
O
O
O
O O
O
O
O
O
O
O
H
H
H
H
H
H
H
H
H
H
H
H
H
H H
H
H
H
H
H
H
H
H
H
H
H
H
H
H H
H H
H
H
H
H
H
H
H
La temperatura a la que el agua adquiere la máxima densi-
dad son 4 °C. La razón es que a esa temperatura aún hay
cristales de hielo que no se han fundido y las moléculas de
agua que se encuentra en estado sólido pueden insertarse
entre los cristales de hielo, de modo que a 4°C, en un mismo
volumen puede haber más moléculas de agua.
12
Investiga qué propiedades del agua se ven condiciona-
das por los enlaces de puente de hidrógeno entre sus
moléculas.
Las uniones entre las moléculas de agua mediante puentes
de hidrógeno hacen que la cohesión entre ellas sea alta. Sin
embargo, resulta paradójico que el agua se encuentre en
estado líquido a temperatura ambiente y que presente una
menor densidad que en estado sólido: se debe al carácter
transitorio de los puentes de agua.
13
Si se introduce una célula en una solución hipertónica,
¿qué sucede? ¿Y si se introduce en una hipotónica?
En una solución hipertónica la célula perderá agua, ya que
saldrá al exterior y como resultado de ello la célula se arruga-
rá (plasmólisis). En una solución hipotónica, entrará agua del
exterior, por lo que su cuerpo celular se hinchará (estado de
turgencia).
14
Tras la lectura de los procesos osmóticos, explica por
qué en una vena solo se puede inyectar un medio isotó-
nico con respecto al medio interno.
En una vena solo se puede inyectar una solución isotónica
porque es la forma de impedir que se produzca, debido al
proceso osmótico, la entrada o salida de agua de los glóbulos
rojos, que podría destruirlos.
15
Observa las siguientes reacciones e indica si son de sín-
tesis o de hidrólisis. Razona la respuesta.
a)
monosacárido + monosacárido
→
disacárido
b)
jabón
→
glicerina + ácidos grasos
c)
aminoácido + aminoácido + aminoácido
→
tripéptido
a)
Reacción de síntesis, ya que precisa un aporte de energía
para llevarse a cabo.
b)
Reacción de hidrólisis, ya que libera energía al producirse.
c)
Reacción de síntesis, ya que precisa un aporte de energía
para llevarse a cabo.


