104
6
2.
LAS ECUACIONES QUÍMICAS
Una
ecuación química
es la forma esquemática de representar una reacción química.
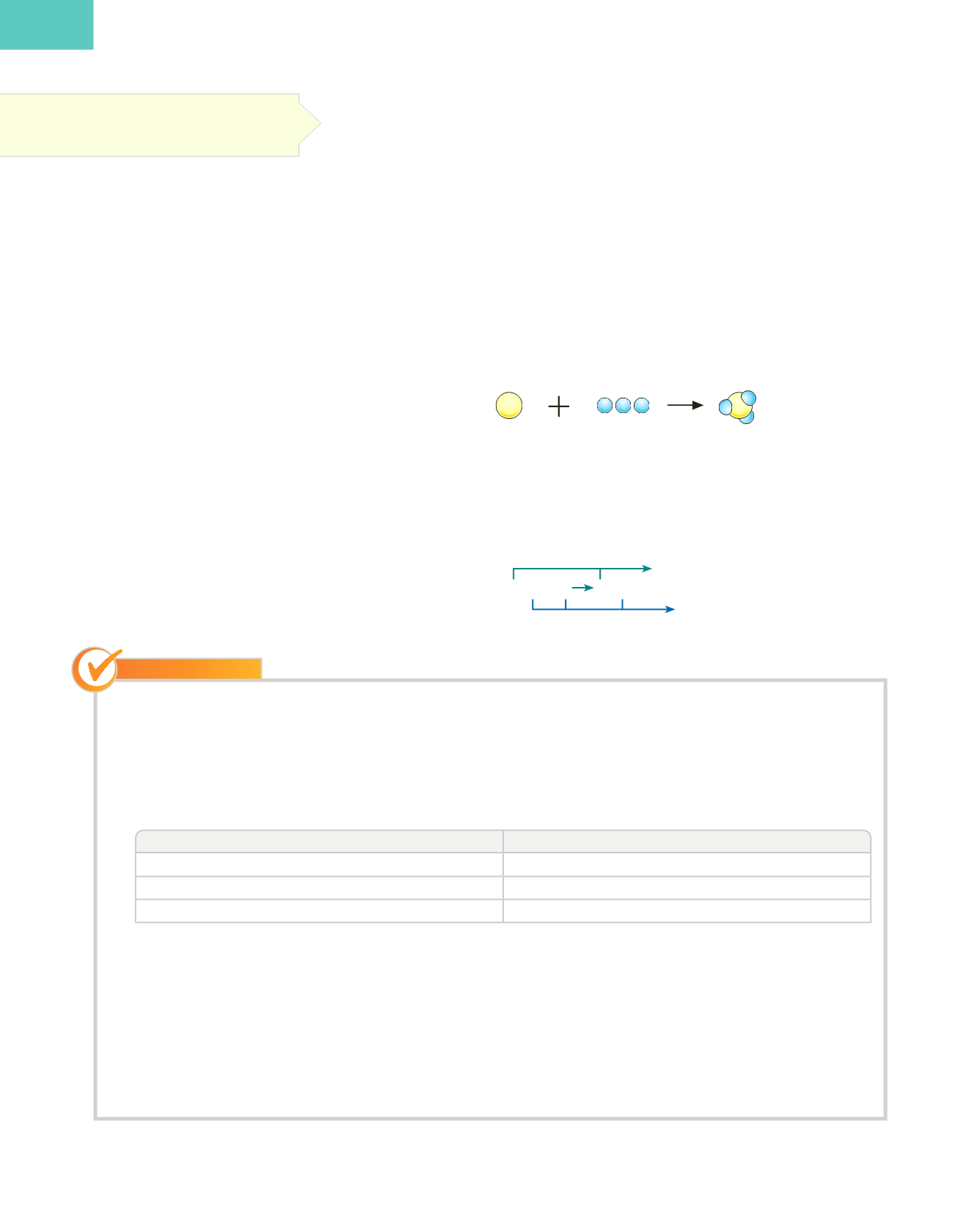
La ecuación de la reacción del azufre y el hierro para dar sulfuro de hierro es:
S (s)
+
Fe (s)
→
FeS (s)
Reactivos
→
Productos
Las sustancias que reaccionan son los
reactivos
y las que se obtienen, los
productos.
El estado físico en el que se encuentran los reactivos y los productos se indica así:
(s) sólido, (l) líquido, (g) gas, (aq) disolución acuosa.
2.1.
¿Cómo se ajustan las ecuaciones químicas?
Una ecuación química debe estar
ajustada
o equilibrada, y para ello ha de haber el
mismo número
de átomos de cada elemento a ambos lados de la ecuación, es decir,
a la derecha y a la izquierda de la flecha.
Para ajustar una ecuación química ponemos delante de las fórmulas de los reactivos
o de los productos unos números, llamados
coeficientes,
que indican el número relati-
vo de átomos y moléculas que intervienen en la reacción. Estos coeficientes nos indican
en qué proporción intervienen las sustancias en la reacción.
Los subíndices de las fórmulas no se modifican nunca, pues eso significaría modificar
las sustancias.
Coeficientes
Subíndices
2 H
2
+
O
2
2 H
2
O
❚❚
En una
reacción química los
reactivos se transforman en
productos.
1.
El metano es el componente mayoritario del gas natural. En la combustión del metano se obtienen dióxido de
carbono y agua y se desprende gran cantidad de energía. La ecuación química de esta reacción es:
CH
4
(g)
+
O
2
(g)
→
CO
2
(g)
+
H
2
O (g)
Ajusta esta ecuación química.
Examinamos uno a uno todos los elementos químicos que aparecen en la ecuación.
N.º de átomos de cada elemento en los reactivos
N.º de átomos de cada elemento en los productos
1 átomo de carbono
1 átomo de carbono
4 átomos de hidrógeno
2 átomos de hidrógeno
2 átomos de oxígeno
3 átomos de oxígeno
C:
Está ajustado. No es necesario añadir ningún coeficiente.
H:
Hay 4 átomos de H a la izquierda y 2 a la derecha, por tanto, ponemos un 2 como coeficiente delante de H
2
O:
CH
4
(g)
+
O
2
(g)
→
CO
2
(g)
+
2 H
2
O (g)
O:
Ahora hay 4 oxígenos a la derecha y solo 2 a la izquierda, por lo que debemos poner un 2 como coeficiente delante
de O
2
:
CH
4
(g)
+
2 O
2
(g)
→
CO
2
(g)
+
2 H
2
O (g)
Comprobamos que todos los elementos han quedado ajustados. El resultado final es:
CH
4
(g)
+
2 O
2
(g)
→
CO
2
(g)
+
2 H
2
O (g)
EJERCICIO RESUELTO


