105
6. Las reacciones químicas
+
www
2.
El hidróxido de sodio sólido (sosa cáustica) reacciona con el ácido sul-
fúrico en disolución acuosa para dar sulfato de sodio y agua. La ecua-
ción química sin ajustar de esta reacción es:
NaOH (s)
+
H
2
SO
4
(aq)
→
Na
2
SO
4
(aq)
+
H
2
O (l)
Ajusta esta ecuación química.
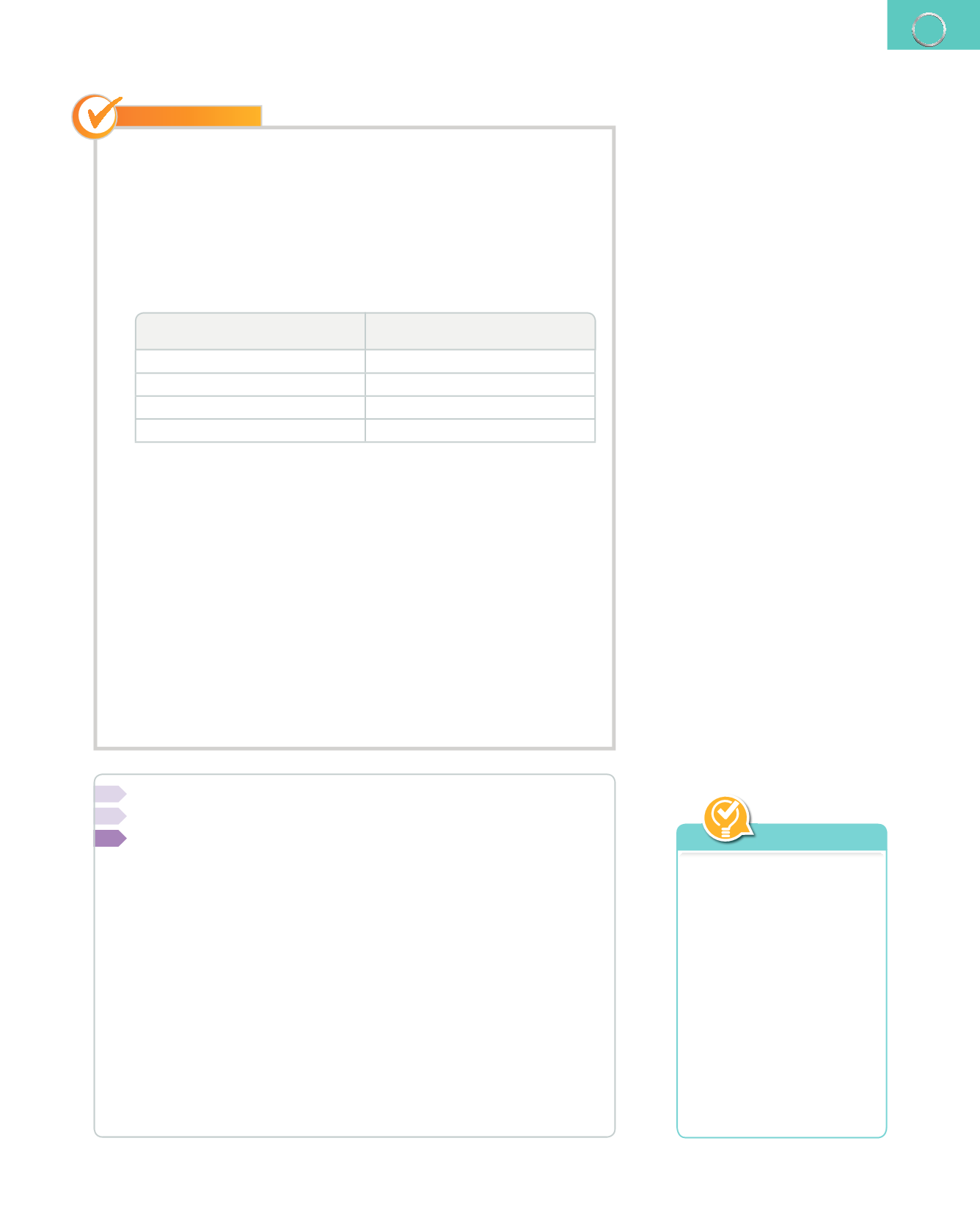
Examinamos uno a uno todos los elementos químicos que aparecen en la
ecuación.
N.º de átomos de cada elemento
en los reactivos
N.º de átomos de cada elemento
en los productos
1 átomo de sodio
2 átomos de sodio
1 átomo de azufre
1 átomo de azufre
5 átomos de oxígeno
5 átomos de oxígeno
3 átomos de hidrógeno
2 átomos de hidrógeno
Na:
Como hay un átomo de sodio a la izquierda y dos a la derecha, debe-
mos poner un 2 como coeficiente delante de NaOH:
2 NaOH (s)
+
H
2
SO
4
(aq)
→
Na
2
SO
4
(aq)
+
H
2
O (l)
H:
Ahora tenemos cuatro átomos de hidrógeno a la izquierda y dos a la
derecha; por consiguiente, pondremos un 2 como coeficiente delante
de H
2
O:
2 NaOH (s)
+
H
2
SO
4
(aq)
→
Na
2
SO
4
(aq)
+
2 H
2
O (l)
O:
Tras estos ajustes, ahora tenemos seis átomos de oxígeno a la izquierda y
seis a la derecha. Por consiguiente, el número de átomos de oxígeno está
ajustado.
S:
Hay un átomo de azufre a la izquierda y otro a la derecha. El número de
átomos de azufre también está equilibrado.
La ecuación ajustada queda así:
2 NaOH (s)
+
H
2
SO
4
(aq)
→
Na
2
SO
4
(aq)
+
2 H
2
O (l)
EJERCICIO RESUELTO
Ideas claras
❚❚
Las reacciones químicas se
representan mediante
ecua-
ciones químicas.
❚❚
Una
ecuación química
está
ajustada cuando a ambos
lados de la flecha existe el
mismo número de átomos de
cada elemento.
❚❚
Los
coeficientes
indican el
número de átomos o molécu-
las de una sustancia que inter-
vienen en una reacción.
❚❚
Los
subíndices
forman parte
de las fórmulas de una sus-
tancia específica.
¿Cuándo decimos que una ecuación química está ajustada?
¿Por qué escribimos 2 NaOH y no Na
2
O
2
H
2
?
Fíjate en las siguientes ecuaciones químicas:
1.
El carbonato de calcio (caliza) se descompone en óxido de calcio y dióxido
de carbono:
CaCO
3
(s)
→
CaO (s)
+
CO
2
(g)
2.
El hidrógeno y el oxígeno reaccionan para dar agua:
H
2
(g)
+
O
2
(g)
→
H
2
O (l)
3.
El azufre reacciona con el cobre para dar sulfuro de cobre:
S (s)
+
Cu (s)
→
CuS (s)
4.
El magnesio en polvo es uno de los componentes de los fuegos artificia-
les, ya que arde en atmósfera de oxígeno para dar un sólido blanco de
óxido de magnesio:
Mg (s)
+
O
2
(g)
→
MgO (s)
a)
Identifica los reactivos y los productos en cada una de ellas y especifica
su estado físico.
b)
Indica cuáles de estas ecuaciones químicas están ajustadas y ajusta las que
no lo estén.
5
6
7


