103
6. Las reacciones químicas
+
www
1.2.
Teoría de colisiones
Pero, ¿cómo crees que se reorganizan los átomos de los reactivos para formar
las nuevas sustancias?
Para responder a esta y otras preguntas sobre cómo se producen las reacciones quími-
cas se recurre a la
teoría de las colisiones,
enunciada por
Lewis
y
Trautz
en 1917.
Para que dos elementos o compuestos reaccionen entre sí, deben romperse unos en-
laces y formarse otros nuevos. Es decir, las partículas de los
reactivos
(átomos, molé-
culas o iones) deben
aproximarse
hasta
chocar.
Como resultado de estos choques se
produce una nueva distribución de átomos, electrones y enlaces y, en consecuencia, la
formación de los
productos
de la reacción.
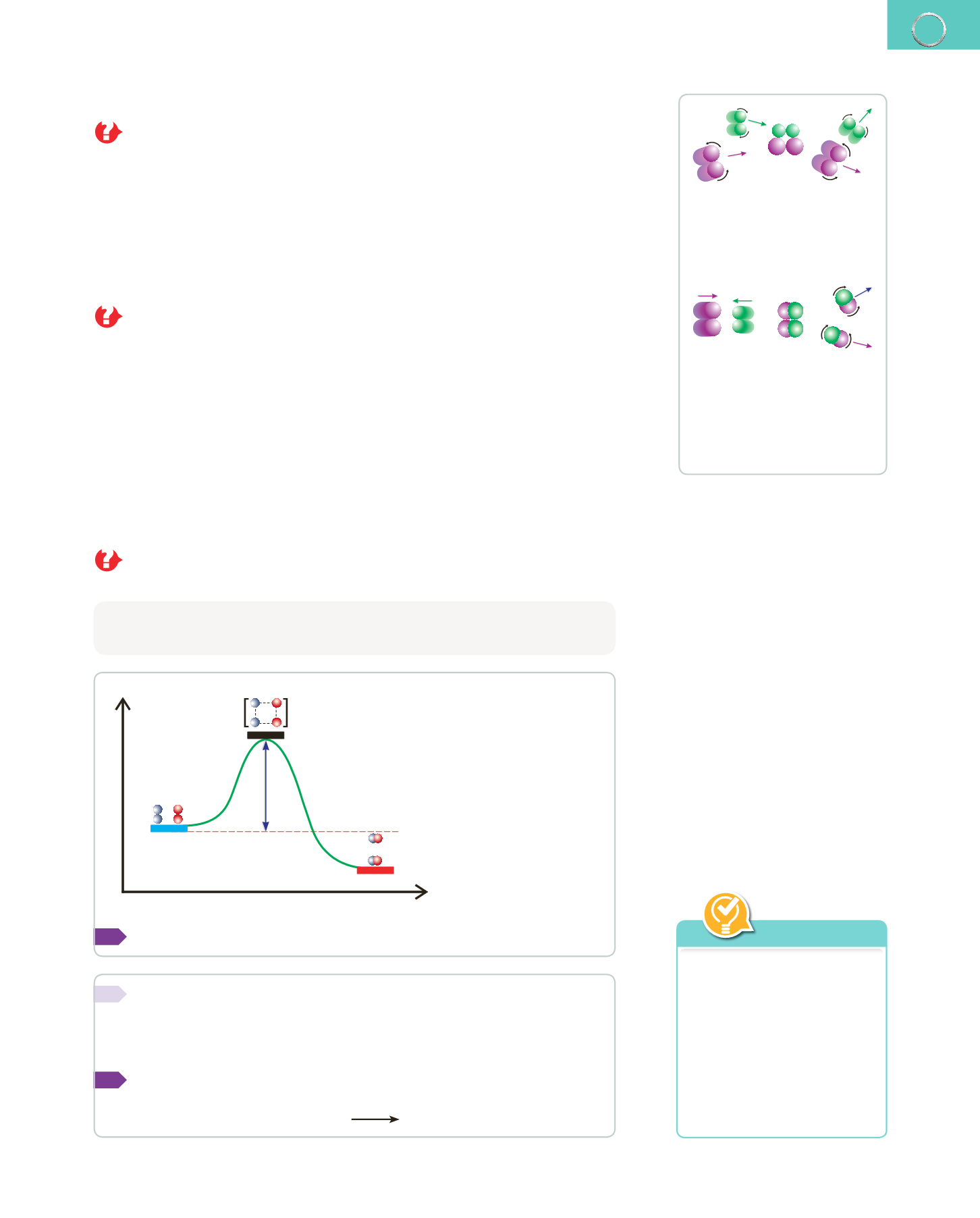
Ahora bien, ¿se produce siempre una reacción química? ¿Generan productos
todos los choques entre partículas?
Para que una reacción se produzca no basta con que los átomos, los iones o las molé-
culas de los reactivos choquen; además, deben hacerlo con la
orientación adecuada
y con la
energía suficiente.
Cuando los reactivos chocan con la orientación adecuada, sus átomos deben pasar
momentáneamente por una distribución de enlaces que tiene
mayor energía
y, por
tanto, es
menos estable
que los reactivos y los productos. Esta distribución de mayor
energía se denomina
complejo activado
y representa una
barrera de energía.
La reacción solo se produce si las moléculas que chocan tienen, además de la orienta-
ción adecuada, una energía suficiente como para superar esa
barrera energética.
En
este caso, decimos que el
choque es efectivo.
Entonces, ¿es eficaz cualquier colisión entre partículas con una energía mayor
que la energía suficiente para superar la barrera energética?
La
energía de activación
es la energía mínima necesaria para que reaccionen dos
átomos, moléculas o iones que chocan con la orientación adecuada.
Las moléculas de los reactivos no
tienen la orientación adecuada
en el momento del choque;
por tanto, no se produce la
reacción química y los reactivos
permanecen inalterados.
Las moléculas de los reactivos
tienen la orientación adecuada
en el momento del choque; por
tanto, se produce la reacción
química. Los reactivos se han
transformado en los productos
de la reacción.
+
+
Sentido de la reacción
Energía
reactivos
productos
complejo
activado
energía de
activación
Las partículas de los
reactivos deben tener
energía suficiente como
para superar la barrera de
energía.
Explica en términos de energía cómo es el avance de la reacción.
2
Clasifica las siguientes transformaciones en físicas o químicas y añade cuatro
ejemplos más:
a)
La ebullición del agua;
b)
La disolución de azúcar en la
leche;
c)
La fermentación de la uva para obtener vino;
d)
La formación del
arcoíris;
e)
La descomposición del AgCl en Cl
2
y Ag por acción de la luz;
f)
La
caída de una piedra desde el borde de un acantilado.
Indica qué enlaces se han roto y cuáles se han formado en la reacción entre
el carbono y el oxígeno para dar dióxido de carbono.
C
+
O
2
CO
2
3
4
Ideas claras
❚❚
Una
reacción química
es la
transformación de una o va-
rias sustancias en otras dife-
rentes.
❚❚
Para que se produzca una
reacción química, las partícu-
las que forman los reactivos
deben tener una
orientación
adecuada
y una
energía su-
ficiente.


