106
6
3.
¿SE CONSERVA LA MASA EN UNA REACCIÓN
QUÍMICA?
❚❚
Al preparar una mezcla o una disolución, la masa total permanece
constante. ¿Ocurre lo mismo con las reacciones químicas?
❚❚
¿Puede ser la suma de la masa de los reactivos mayor que la de los produc-
tos? ¿Y a la inversa?
Para dar respuesta a estas preguntas vamos a analizar lo que sucede si hacemos reac-
cionar nitrato de plata, AgNO
3
, con ácido clorhídrico, HCl, para dar cloruro de plata,
AgCl, y ácido nítrico, HNO
3
. La ecuación química de esta reacción es:
AgNO
3
(aq)
+
HCl (aq)
→
AgCl (s)
+
HNO
3
(aq)
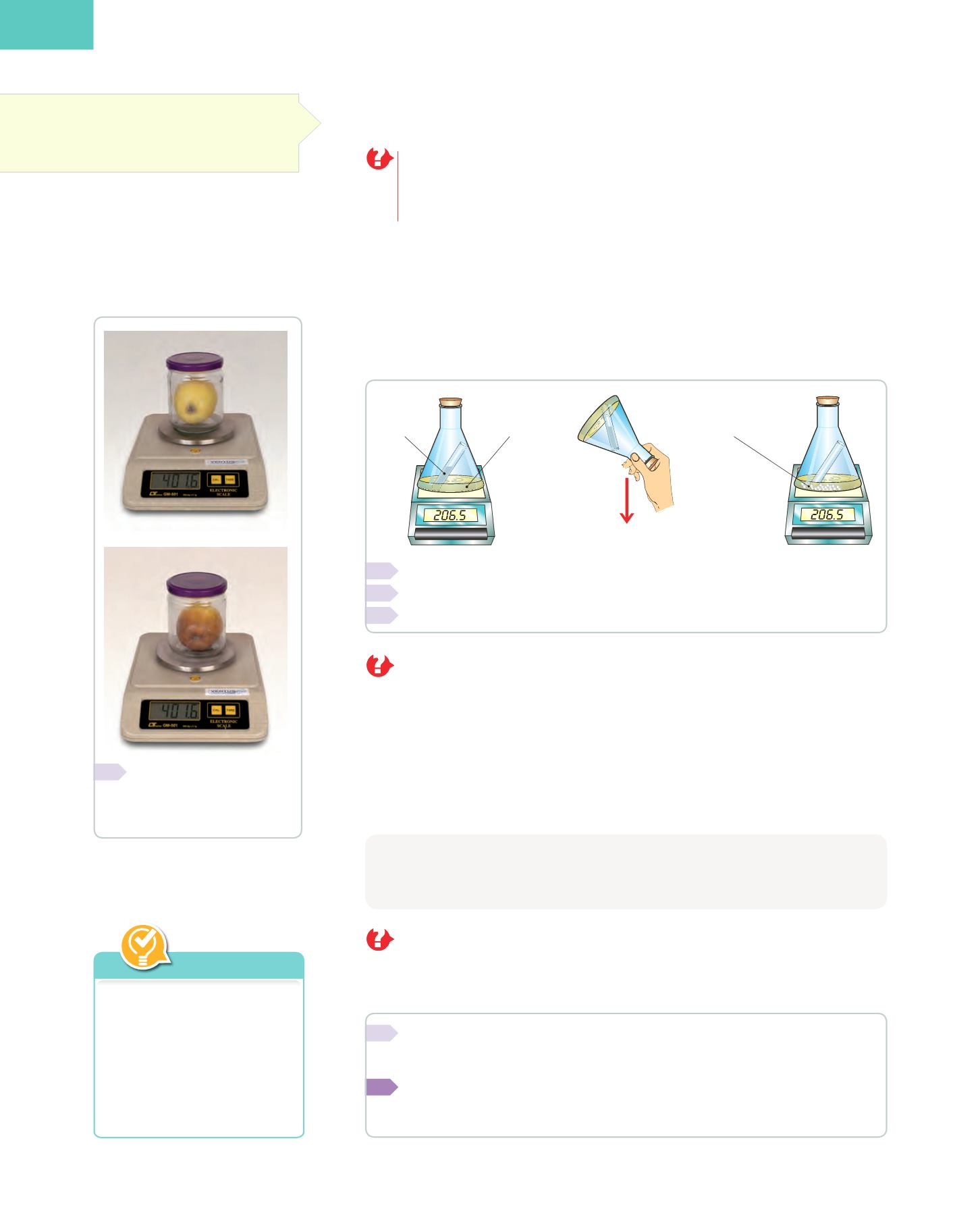
Inicialmente, el matraz erlenmeyer contiene una disolución de nitrato de plata y el tubo
de ensayo, una disolución de ácido clorhídrico. Al poner en contacto ambas sustancias
se forma un precipitado blanco de cloruro de plata.
¿Qué sucedería si en la reacción intervinieran sustancias gaseosas?
Colocamos una manzana en el interior de un recipiente cerrado sobre una báscula
digital. Al cabo de unos días, la fruta se ha descompuesto y queda menos oxígeno
en el aire del recipiente, porque se ha combinado con algunas sustancias de la fruta.
Sin embargo, hay más dióxido de carbono y otros gases, liberados en su putrefacción.
Observa que la balanza marca la misma masa que indicaba inicialmente.
Podemos, entonces, comprobar que en una reacción química se cumple el
principio
de conservación de la masa,
también conocido como
ley de Lavoisier:
En cualquier reacción química que tenga lugar en un
sistema cerrado,
la
masa
total
de las sustancias allí existentes
se conserva,
es decir, la suma de las masas
de los reactivos es igual a la suma de las masas de los productos.
¿Habrá el mismo número de átomos en los reactivos que en los productos?
Lógicamente sí, ya que en una reacción química los átomos no desaparecen, sino que
se ordenan (enlazan) de un modo diferente.
❚❚
Los reactivos son las
sustancias de partida y los
productos son las nuevas
sustancias.
Volcamos el erlenmeyer para que el HCI contenido
en el tubo de ensayo se vierta.
Precipitado de AgCI (sólido
de color blanco) y HNO
3
(disolución incolora)
Disolución
incolora de
AgNO
3
Disolución
incolora
de HCI
Identifica los reactivos y los productos e indica su estado físico.
¿Se conserva la masa en esta reacción química? ¿Por qué?
Nombra el material de laboratorio necesario para realizar esta experiencia.
8
89
810
Pesamos una vela antes y después de encenderla y observamos que, tras su
combustión, la masa de la vela ha disminuido. ¿No se cumple la ley de con-
servación de la masa? ¿Qué crees que ha sucedido?
Quieres comprobar que en la reacción de oxidación de un metal se cumple
la ley de conservación de la masa. ¿Qué utilizarías para ello, un recipiente
abierto o uno cerrado? ¿Por qué?
12
13
Ideas claras
❚❚
En toda reacción química la
suma de las masas de los re-
activos es igual a la suma de
las masas de los productos.
❚❚
En una reacción química solo
cambia la organización de los
átomos y, por tanto, la masa
inicial es igual a la masa final.
¿Se conserva la masa en
esta reacción química? ¿Por
qué utilizamos un recipiente
herméticamente cerrado?
11


