109
6. Las reacciones químicas
+
www
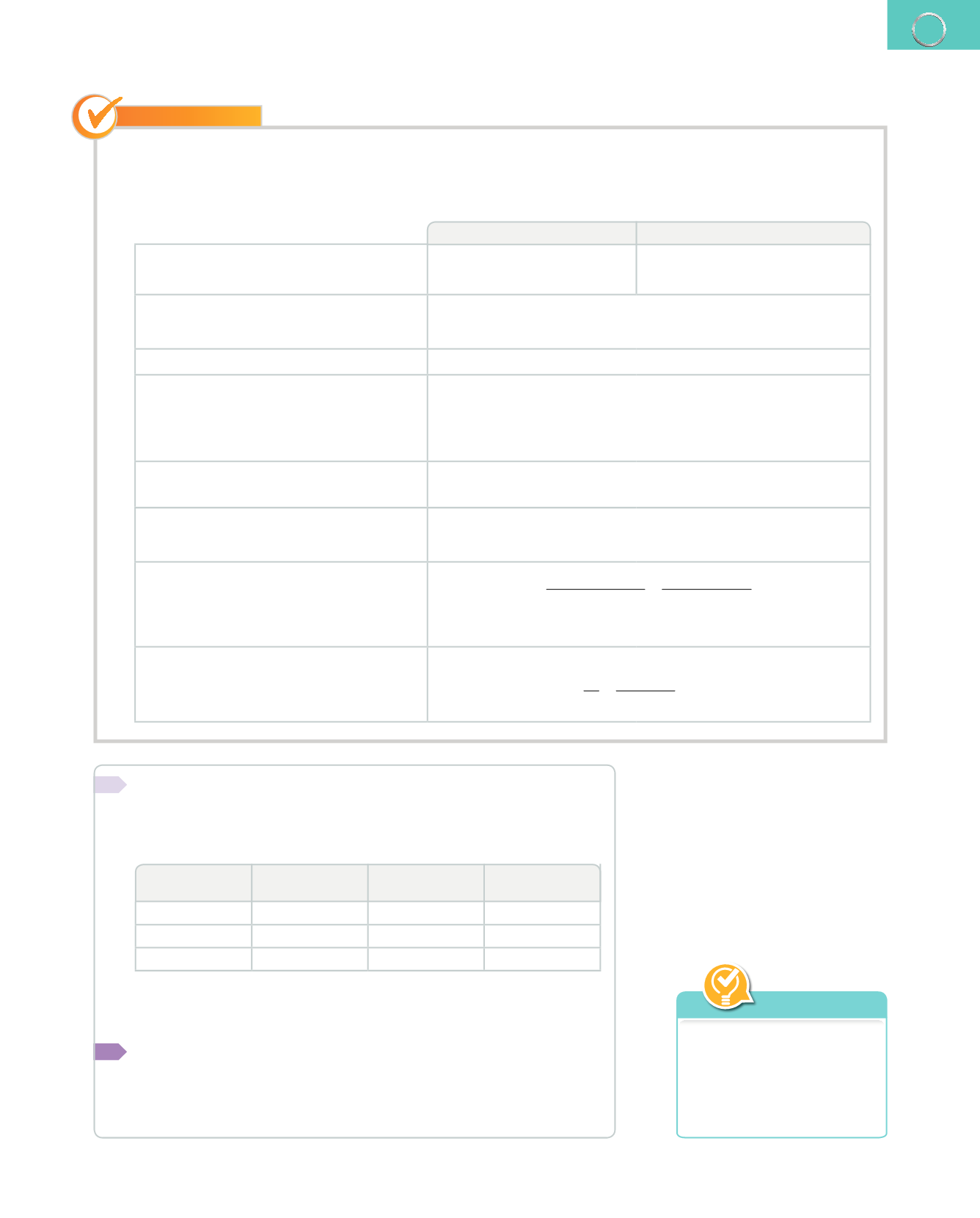
4.
Cuando el carbonato de calcio sólido, CaCO
3
, reacciona con el ácido clorhídrico, HCl, diluido, se obtienen clo-
ruro de calcio, CaCl
2
, soluble, agua líquida y dióxido de carbono, que se desprende en forma de gas. Calcula
la cantidad de cloruro de calcio que se obtiene cuando 50 g de carbonato de calcio reaccionan con la cantidad
suficiente de ácido clorhídrico.
Reactivos
Productos
1.
Se identifican los reactivos y los productos. Carbonato de calcio: CaCO
3
Ácido clorhídrico: HCI
Cloruro de calcio: CaCl
2
; Agua: H
2
O
Dióxido de carbono: CO
2
2.
Se escribe la ecuación química, incluyendo,
además de los símbolos y fórmulas, el
estado físico de las sustancias.
CaCO
3
(s)
+
HCl (aq)
→
CaCl
2
(aq)
+
H
2
O (l)
+
CO
2
(g)
3.
Se ajusta o equilibra la ecuación.
CaCO
3
(s)
+
2 HCl (aq)
→
CaCl
2
(aq)
+
H
2
O (l)
+
CO
2
(g)
4.
Se indica debajo de cada componente
la cantidad de sustancia, en mol. Este
número coincide con el que figura delante
de cada símbolo o fórmula, si no aparece
indicado, se trata de 1 mol.
CaCO
3
(s)
+
2 HCl (aq)
→
CaCl
2
(aq)
+
H
2
O (l)
+
CO
2
(g)
1 mol
2 mol
1 mol
1 mol 1 mol
5.
Se añade la masa atómica relativa de cada
sustancia o su masa molecular relativa.
CaCO
3
(s)
+
2 HCl (aq)
→
CaCl
2
(aq)
+
H
2
O (l)
+
CO
2
(g)
100
36,5
111
18
44
6.
Se escriben las masas de las sustancias,
teniendo en cuenta las cantidades
relativas que figuran en la ecuación.
CaCO
3
(s)
+
2 HCl (aq)
→
CaCl
2
(aq)
+
H
2
O (l)
+
CO
2
(g)
100 g 2
⋅
36,5
=
73 g 111 g
18 g
44 g
7.
Se establece la equivalencia entre las
cantidades estequiométricas
1
y los datos
del enunciado.
100 g de CaCO
3
50 g de CaCO
3
=
111 g de CaCl
2
x
g de CaCl
2
x
=
55,5 g de CaCl
2
8.
Se calcula la cantidad de sustancia, en
mol.
Con 50 g de CaCO
3
se obtienen 55,5 g de CaCl
2
, que son:
n
=
m
M
=
55,5 g
111g/mol
=
0,5 mol
EJERCICIO RESUELTO
El calcio reacciona con el oxígeno del aire para dar óxido de calcio (cal viva):
calcio
+
oxígeno
→
óxido de calcio
Copia en tu cuaderno y calcula
x, y, z
aplicando la ley de conservación de
la masa:
Experimento
Masa de
calcio (g)
Masa de
oxígeno (g)
Masa de óxido
de calcio (g)
1
8
3,2
z
2
4
y
5,6
3
x
0,8
2,8
a)
Comprueba que estos datos cumplen la ley de las proporciones constan-
tes.
b)
Calcula el porcentaje de calcio y oxígeno en el óxido de calcio.
Tenemos 3,07 g de magnesio que reaccionan exactamente con 2,02 g de
oxígeno para formar óxido de magnesio. ¿Qué cantidad de óxido de mag-
nesio se obtiene? Calcula el porcentaje de oxígeno y de magnesio en el
óxido de magnesio.
Solución:
5,09 g, 0,126 mol; % de Mg
=
60,3%; % de O
=
39,7%
17
178
Ideas claras
❚❚
Los
cálculos estequiométri-
cos
en una reacción química
son necesarios para obtener
la cantidad de una sustancia
que reacciona o la cantidad
de sustancia obtenida.
1
cantidad estequiométrica:
la que nos
indica los coeficientes que se utilizan
para ajustar una ecuación química.


