111
6. Las reacciones químicas
+
www
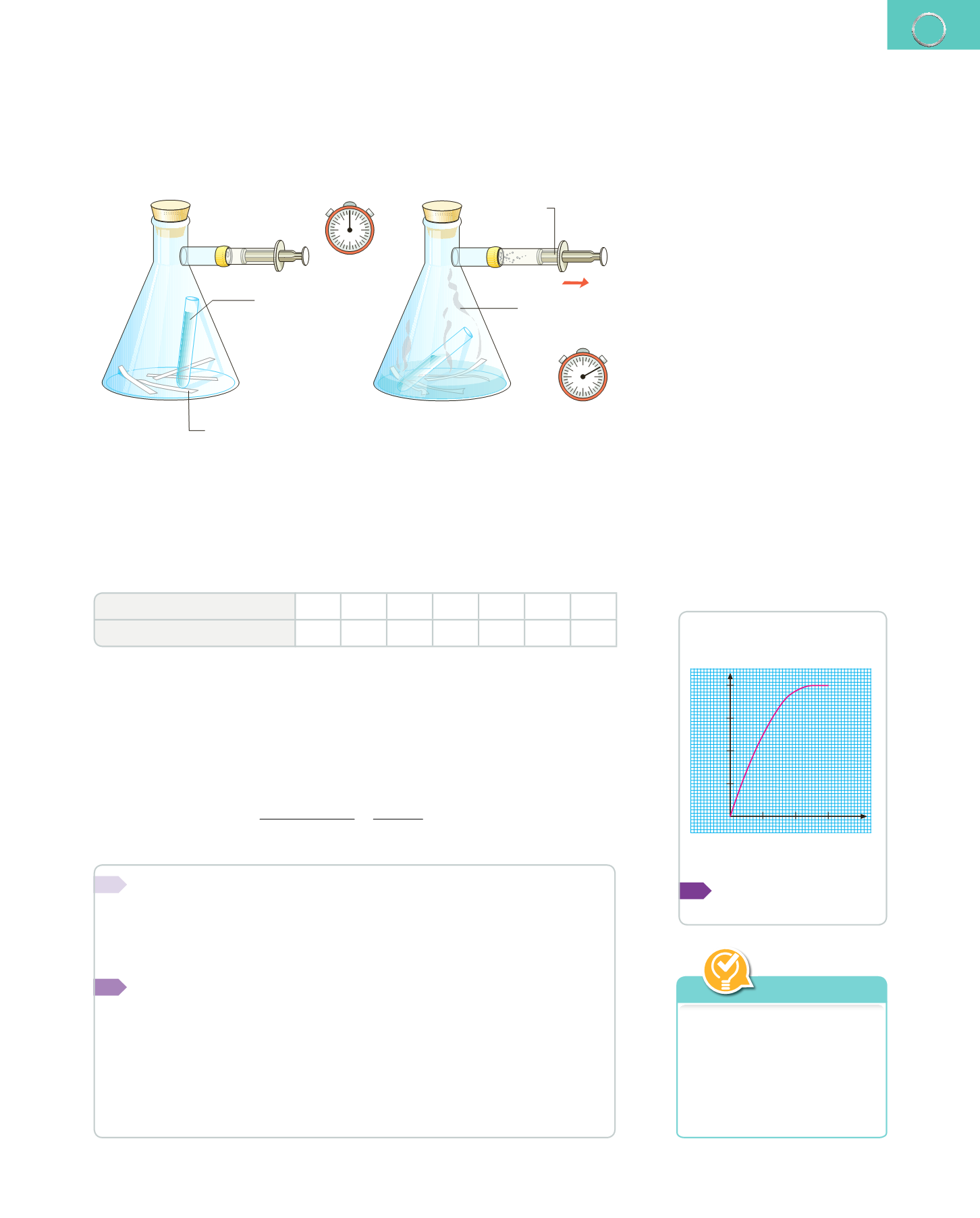
La cantidad de hidrógeno gaseoso que se obtiene es la sustancia más fácil de medir.
Por tanto, para medir la velocidad de esta reacción utilizaremos un dispositivo como el
del dibujo, en el que las cintas de magnesio están en el fondo del matraz erlenmeyer y
el ácido clorhídrico en el tubo de ensayo que hay en su interior.
HCl diluido en
el tubo de ensayo
Tiras de magnesio
en el fondo del matraz erlenmeyer
Hidrógeno
gaseoso
Émbolo
1.
2.
Inclinamos el erlenmeyer de manera que los dos reactivos entren en contacto y, en ese
momento, ponemos en funcionamiento el cronómetro.
Observamos que el hidrógeno que se produce comienza a burbujear y, a medida que
llega al tubo lateral, el émbolo de la jeringuilla se desplaza, lo que nos permite medir el
hidrógeno recogido cada cierto intervalo de tiempo.
Los datos que hemos obtenido son los siguientes:
Tiempo (min)
0
1
2
3
4
5
6
Volumen de hidrógeno (cm
3
)
0 14 25 33 38 40 40
Si analizamos estos resultados, observamos que la velocidad de la reacción no es cons-
tante, sino que varía en el transcurso de la misma:
❚❚
Es muy rápida en el primer minuto, pero disminuye a medida que la reacción tiene
lugar.
❚❚
A los cinco minutos no se produce más hidrógeno y la reacción ha finalizado.
❚
Por tanto, la
velocidad media
de esta reacción es:
velocidad media
=
volumen de H
2
tiempo total
=
40 cm
3
5 min
=
8 cm
3
de H
2
por minuto
Ideas claras
❚❚
La
velocidad de reacción
es
la cantidad de sustancia for-
mada o transformada en la
unidad de tiempo, según se
utilice para medirla un pro-
ducto o un reactivo, respecti-
vamente.
Representación gráfica
de los datos de la tabla
t (min)
2 4 6
10
20
30
0
40
V
H
2
(cm
3
)
Volumen de hidrógeno obtenido
en función del tiempo.
Haz un estudio cualitati-
vo de la gráfica obtenida.
19
Clasifica en lentas y rápidas las reacciones siguientes:
a)
La combustión del gas en una cocina.
b)
La maduración de la fruta.
c)
La combustión de una bengala.
d)
La cocción de un huevo.
Responde a las siguientes cuestiones utilizando la gráfica de la reacción del
magnesio con el ácido clorhídrico:
a)
¿Qué volumen de hidrógeno se ha obtenido a los 2,5 min?
b)
¿Y a los 3,5 min?
c)
¿Qué tiempo tiene que transcurrir para obtener 20 cm
3
de hidrógeno?
d)
¿Y para obtener 30 cm
3
?
e)
Calcula la velocidad de esta reacción en el primer minuto, en el segundo
minuto y en el tercer minuto.
1720
1721


