113
6. Las reacciones químicas
+
www
6.2.3.
Influencia de la temperatura de los reactivos
Si repetimos la reacción entre el magnesio y el ácido clorhídrico diluido, pero en
esta ocasión aumentamos 10 ºC la temperatura de los reactivos, observamos que la
velocidad media de la reacción prácticamente se duplica, ya que se tardan 2,5 min en
obtener 40 cm
3
de hidrógeno.
La
velocidad
de la reacción, generalmente, se
incrementa
al
aumentar
la
tempe-
ratura.
Por ello, la baja temperatura a la que se encuentra el interior de un frigorífico
hace que la velocidad de descomposición de los alimentos disminuya.
❚❚
Justificación mediante la teoría de las colisiones
La velocidad de una reacción se incrementa al elevar la temperatura de los reactivos
porque, de acuerdo con la teoría cinética de la materia, un aumento de la temperatura
implica un aumento de la velocidad de las partículas, y esto provoca que los choques
entre ellas sean más eficaces.
Baja temperatura
Alta temperatura
Las partículas se mueven a poca velocidad y
el número de choques entre ellas es bajo, por
lo que la posibilidad de que reaccionen es
también baja.
Las partículas se mueven a gran velocidad y
el número de choques entre ellas es elevado,
por lo que la posibilidad de que reaccionen
es también muy alta.
6.2.4.
Influencia de la presencia de catalizadores
Los
catalizadores
son sustancias distintas de los reactivos y de los productos que mo-
difican la velocidad de una reacción, acelerándola o retardándola. Al finalizar esta, los
catalizadores se recuperan inalterados.
Las levaduras actúan como catalizadores en la fabricación del pan, las enzimas catali-
zan las reacciones que tienen lugar en nuestro cuerpo, el catalizador de los vehículos
impide que estos emitan gases perjudiciales a la atmósfera, etc.
❚❚
Justificación mediante la teoría de las colisiones
Ciertos catalizadores pueden formar un
complejo activado
con una
energía de
activación menor,
de manera que un mayor número de partículas de los reactivos
puedan superarla; en este caso aumenta la velocidad de la reacción.
Otros forman un
complejo activado
que tiene una
energía de activación mayor,
lo que disminuye la velocidad de la reacción.
Ideas claras
❚❚
La
velocidad de una reac-
ción
se incrementa cuando
se aumenta la concentración
de los reactivos, su grado de
división y la temperatura.
❚❚
Los
catalizadores
pueden
acelerar o retardar una reac-
ción química.
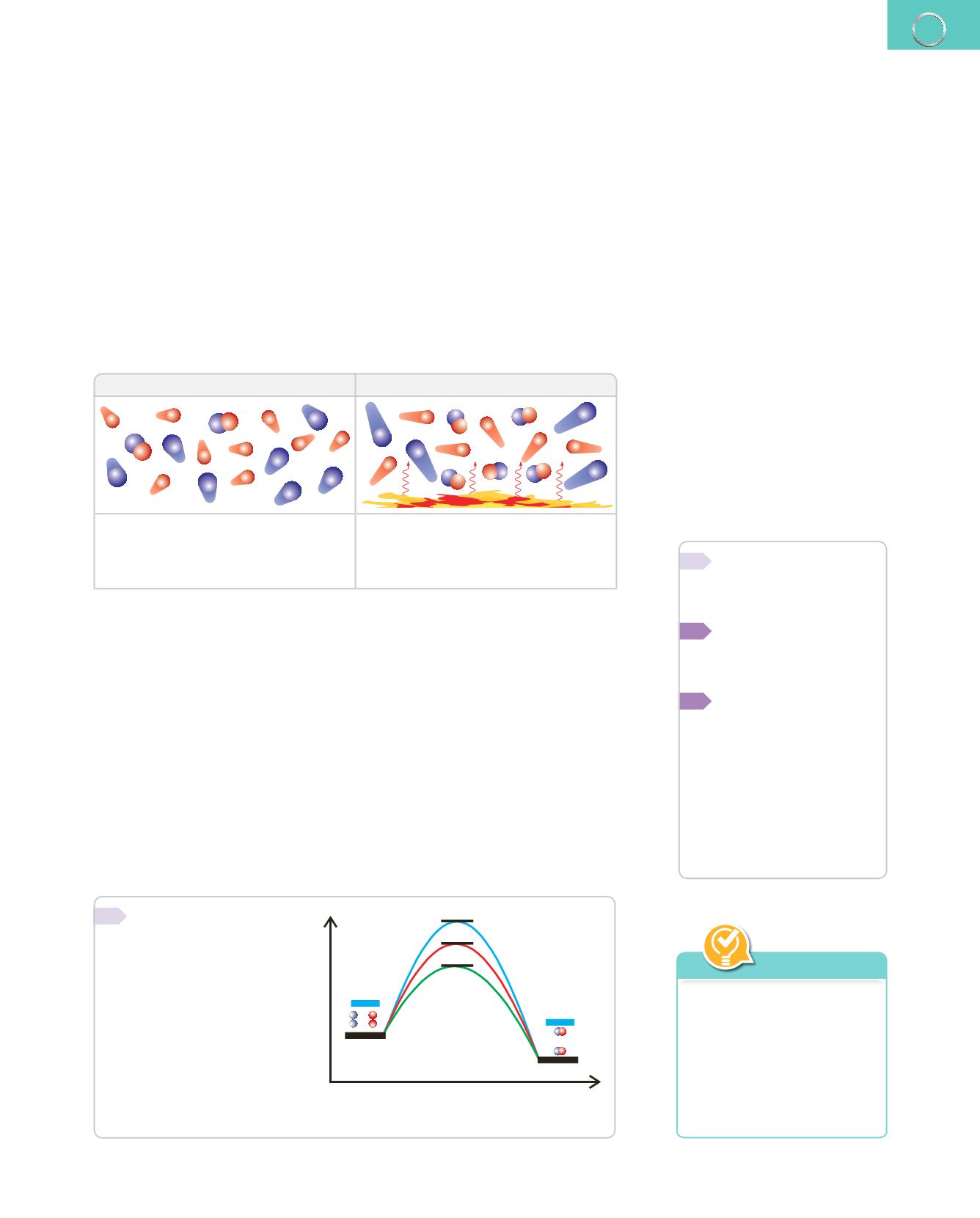
Sabiendo que la curva
2
representa la energía de
activación de una reac-
ción sin catalizador:
a)
¿A qué curva le corres-
ponde una menor velo-
cidad de reacción? ¿Por
qué?
b)
¿Cómo influye el com-
plejo activado en las
curvas
1
y
3
?
c)
¿Por qué el catalizador
aparece tanto en los reactivos como en los productos?
1723
+
+
Sentido de la reacción
Energía
productos
1
2
3
catalizador
catalizador
reactivos
¿Por qué un tronco de
madera arde con más dificul-
tad que la misma madera en
astillas?
¿Por qué en el envase de
los alimentos precocinados se
recomienda que se conserven
entre 0 ºC y 5 ºC?
El agua oxigenada se
descompone rápidamente en
agua y oxígeno cuando se le
agrega una pequeña cantidad
de dióxido de manganeso,
que no se altera durante la
reacción y se recupera total-
mente al finalizar la misma.
¿Cómo se comporta el dió-
xido de manganeso en esta
reacción?
24
25
26


