141
Niveles de organización de los seres vivos
2.
Los componentes químicos de los seres vivos
La bioquímica es una forma de estudiar la biología que persigue interpretar los pro-
cesos vitales orgánicos en términos de la estructura y la dinámica de las moléculas
que constituyen un organismo vivo.
Luis F
ranco
V
era
El carbono (C) es el principal elemento químico formador de la materia viva, porque
posee características que lo hacen único dentro de los elementos conocidos:
z
Es muy abundante en la Tierra y accesible para los seres vivos.
z
Se trata de un elemento estable.
z
Posee valencia 4 y gran facilidad para formar cadenas: cada átomo de carbono
puede unirse a otros cuatro, y también a átomos sencillos, mediante enlaces cova-
lentes.
Junto con el carbono, los elementos oxígeno (O), hidrógeno (H), nitrógeno (N), fós-
foro (P) y azufre (S) constituyen el 99% de la materia viva: son los
bioelementos
mayoritarios
o
primarios.
Otros, como el sodio (Na), el potasio (K), el calcio (Ca), el magnesio (Mg) y el cloro
(Cl) se encuentran en menores proporciones y se consideran
bioelementos secun-
darios.
Un tercer grupo lo constituyen aquellos que están presentes en cantidades inferiores
al 0,1%, pero resultan imprescindibles para la vida: son los
oligoelementos
hierro
(Fe), cobre (Cu), cinc (Zn), manganeso (Mn), yodo (I), níquel (Ni) y cobre (Cu).
Las moléculas formadas a partir de los bioelementos se conocen como
biomolécu-
las
y constituyen la materia viva.
2.1.
Los enlaces químicos en las biomoléculas
Las biomoléculas poseen enlaces químicos (figura 7.6) fundamentales para mante-
ner sus estructuras y posibilitar su función en las células. Los principales son:
z
Enlace covalente:
es el enlace más fuerte. Permite que las moléculas se man-
tengan estables en el medio acuoso celular. Las que presentan enlaces covalentes
pueden mostrar comportamientos muy diferentes, desde poseer zonas hidrófobas
e hidrófilas (como los fosfolípidos) o ser solubles en agua (como los monosacári-
dos), hasta ionizarse en un medio acuoso (como los aminoácidos). Esto explica la
enorme diversidad de las biomoléculas.
z
Enlace iónico:
se encuentra en moléculas que forman parte de estructuras iner-
tes, como exoesqueletos de diatomeas o caparazones de moluscos, o en otras
como el cloruro de sodio (NaCl), que en las células está disuelto, por lo que sus
iones Cl
–
y Na
+
están disociados.
z
Enlace de puente de hidrógeno:
es un enlace débil que se establece entre dos
zonas de una molécula muy próximas y con cargas parciales de distinto signo. Se
trata de un estabilizador de estructuras en macromoléculas como el ADN, en el
que consolidan la doble hélice.
z
Fuerzas de van der Waals:
son interacciones eléctricas, débiles y temporales,
fundamentales para el mantenimiento de la conformación de las macromoléculas
o en las uniones antígeno-anticuerpo.
2.2.
Clasificación de las biomoléculas
Las biomoléculas pueden diferenciarse según su composición química, es decir, se-
gún si el elemento mayoritario es o no el carbono.
z
Biomoléculas inorgánicas:
no están constituidas por cadenas de carbono.
z
Biomoléculas orgánicas:
están formadas por cadenas de carbono.
Enlace iónico
Ion
negativo
Ion
positivo
Electrones
transferidos
Electrones
compartidos
Enlace covalente
Molécula
ÁTOMOS
ÁTOMOS
Figura 7.6.
El enlace covalente se establece
entre dos átomos que comparten electrones
y completan, así, su último orbital. El enla-
ce iónico se establece entre iones con cargas
opuestas: el ion positivo cede un electrón al
ion negativo.
Actividades
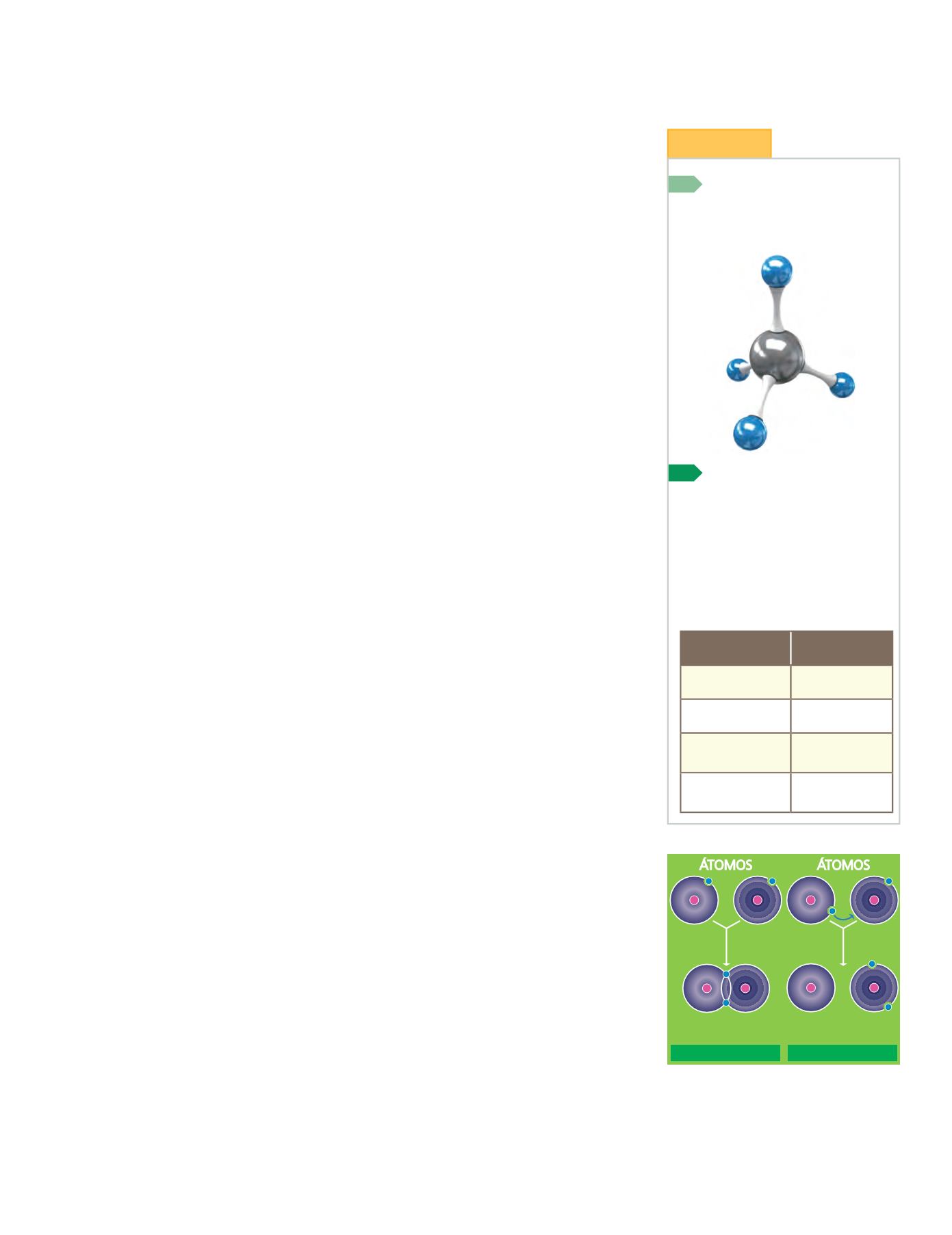
8
Observa el modelo molecular
del metano, recuerda la fórmula
del propano y representa su mo-
delo molecular.
9
La energía requerida para
formar un enlace químico es la
misma que se necesita para rom-
perlo. Observa la siguiente tabla,
donde se indica la energía de cada
tipo de enlace químico. Haz un
diagrama de barras y escribe tus
conclusiones sobre la fortaleza de
cada tipo de enlace.
Tipo de enlace Energía kcal/mol
Covalente
50 a 100
Iónico
1 a 80
Puente de
hidrógeno
3 a 6
Fuerzas de
Van der Waals
0,5 a 1


