142
Unidad 7
3.
Las biomoléculas inorgánicas
Casi todos los aspectos de la vida se organizan en el nivel molecular, y si no
entendemos las moléculas, nuestra comprensión de la vida misma será muy in-
completa.
Francis C
rick
(1916-2004)
Aparecen en los seres vivos y en la materia inerte y resultan indispensables para el
desarrollo de las funciones vitales.
3.1.
El agua
Es muy abundante en la Tierra y posee características que la hacen imprescindible
para los seres vivos. Entre ellas, destacan las siguientes:
z
Estado líquido a temperatura ambiente:
la gran cohesión de sus moléculas (la
fuerza que las mantiene unidas) permite que el agua permanezca en estado líqui-
do a temperaturas no extremas, lo cual facilita su papel como medio de transporte
en el interior de los organismos vivos.
z
Poder disolvente:
la especial estructura de su molécula, polar, permite que se
interponga entre los iones que forman las moléculas de soluto, separándolos y ha-
ciendo posible su disolución. La mayor parte de las reacciones biológicas ocurren
en el agua, que también participa en muchos procesos de transporte biológico.
z
Características térmicas:
sus elevados calor específico
1
y calor de vaporización
le otorgan un importante papel en el mantenimiento de la temperatura interna
constante que necesitan los organismos vivos para su metabolismo.
z
Menor densidad en estado sólido que en estado líquido:
esta característica
única hace que el hielo flote sobre el agua líquida. Así se asegura la existencia, bajo
la capa de hielo, de agua líquida en la que pueden vivir numerosos organismos.
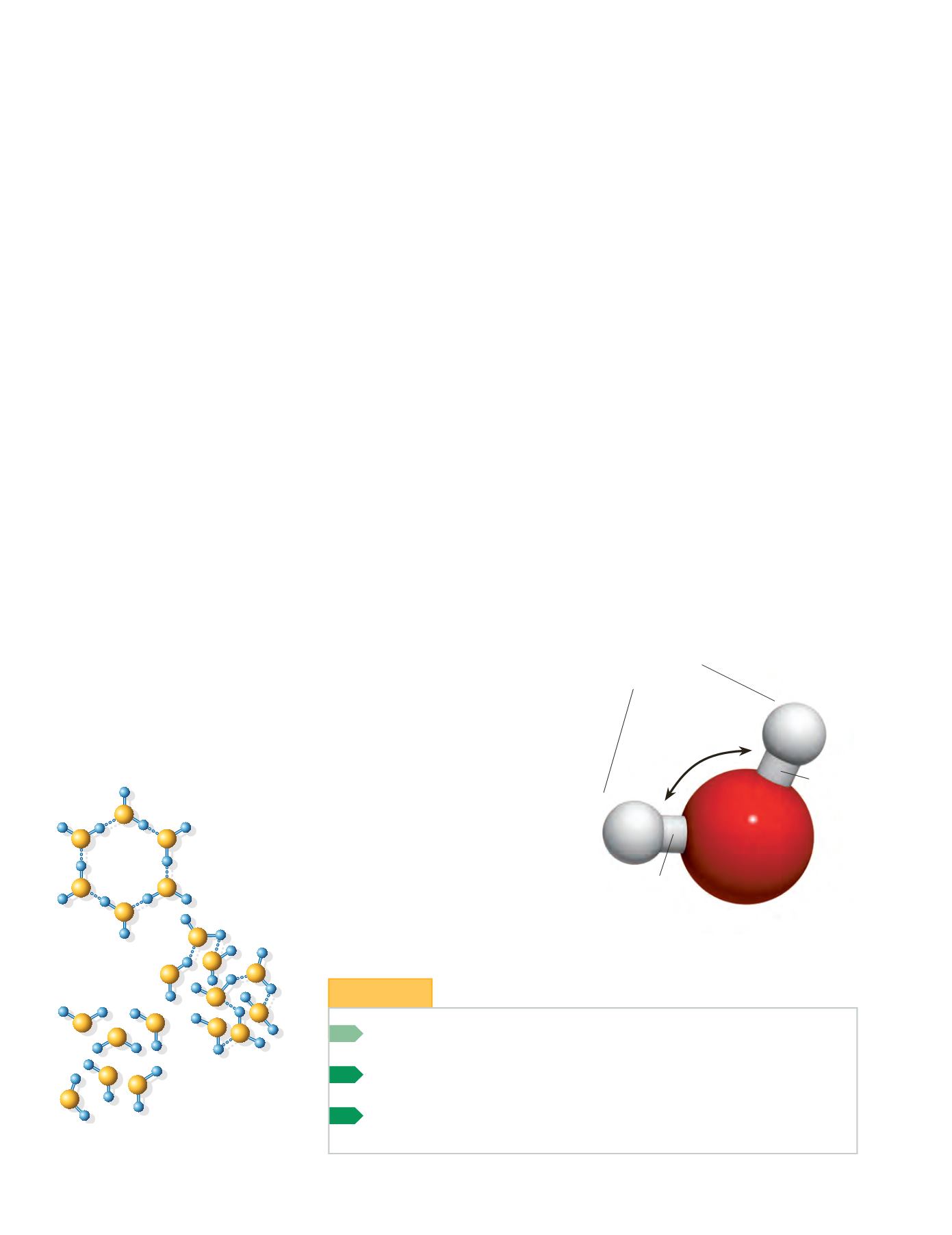
Las características del agua proceden de
la estructura de su molécula (figura 7.7):
cada una de ellas está formada por dos
átomos de hidrógeno unidos a uno de
oxígeno mediante
enlaces covalentes.
Los átomos de hidrógeno forman res-
pecto al oxígeno un ángulo de 104,5º.
Se crea así una asimetría eléctrica, pues
una zona queda cargada positivamente
(la correspondiente a los átomos de H)
y la otra negativamente (la de la zona
del O), de forma que la molécula tiene
carácter dipolar.
Esto favorece la for-
mación de enlaces de puente de hidró-
geno entre las moléculas de agua; esta
estructura molecular condiciona varias
de sus propiedades.
O
H
Sólido
Líquido
Gaseoso
O
O
O
O
O
O
O
O
O
O
O
O O
O
O
O
O
O
O
H
H
H
H
H
H
H
H
H
H
H
H
H
H H
H
H
H
H
H
H
H
H
H
H
H
H
H
H H
H H
H
H
H
H
H
H
H
Figura 7.8.
Modelos moleculares del agua en
distintos estados
Actividades
10
Busca y cita dos ejemplos en los que el agua participe en la regulación
térmica de un organismo vivo.
11
Investiga cuál es la temperatura a la que el agua adquiere la máxima
densidad. Observa la figura 7.8 y explica cuál es la razón.
12
Investiga qué propiedades del agua se ven condicionadas por los enlaces
de puente de hidrógeno entre sus moléculas.
1
calor específico:
es el calor que
hay que aplicar a una masa para ele-
var un grado su temperatura.
Figura 7.7.
Modelo molecular del agua.
104,5º
región
electropositiva
enlace
covalente
región
electronegativa
enlace
covalente
δ
+
δ
+
δ
–


